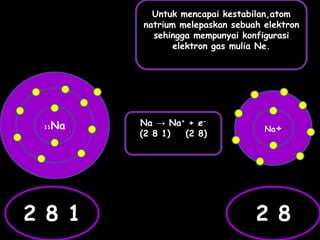
Dokumen tersebut membahas tentang ikatan ionik dan sifat senyawa ionik. Secara singkat, dikemukakan bahwa (1) atom akan stabil jika memiliki konfigurasi elektron seperti gas mulia, (2) ikatan ion terjadi karena tarik menarik antara ion positif dan negatif, (3) senyawa ion memiliki sifat seperti kristal yang keras tetapi rapuh, titik lebur dan didih tinggi, mudah larut dalam air, serta dapat mengh