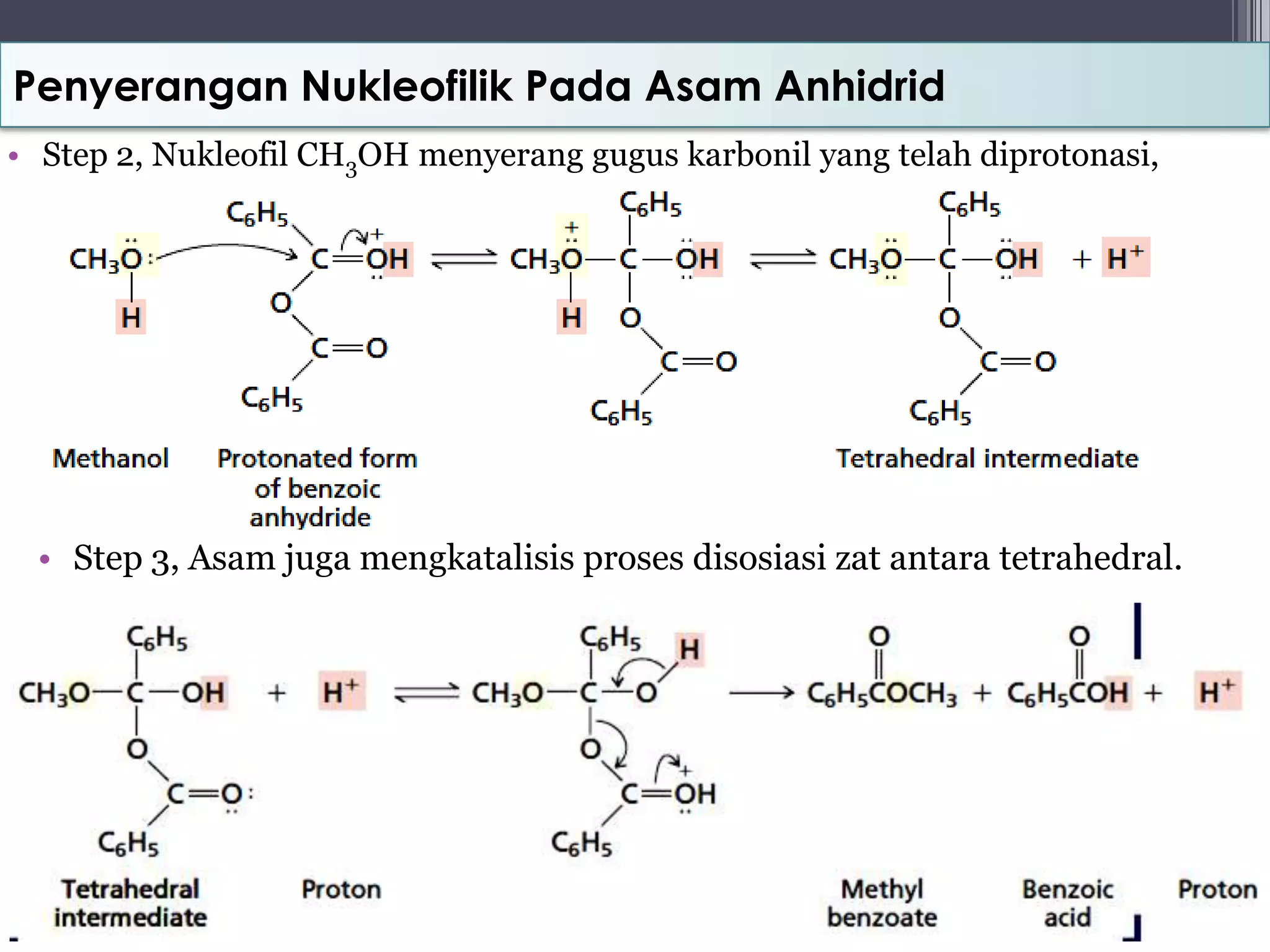
Dokumen ini membahas mekanisme penyerangan nukleofilik termasuk reaksi SN1, SN2, E1, E2, dan reaksi yang melibatkan epoksida, amida, dan ester. Penekanan diberikan pada perbedaan struktur dan perilaku nukleofil, serta pembentukan produk reaksi yang berbeda tergantung pada jenis reaksi dan kondisi reaksi. Selain itu, dokumen ini juga memberikan contoha mekanisme reaksi yang mencakup hidrolisis dan adisi nukleofilik pada senyawa karbon.