Recommended
PDF
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
PDF
PPTX
PDF
PDF
PDF
PDF
การคำนวณเกี่ยวกับสูตรเคมี
PDF
เคมีไฟฟ้า (Electrochemistry)
PDF
PDF
PDF
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
PDF
PDF
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 2
PDF
Lab 2 ปฏิกิริยาระหว่างกรดกับเบส
PDF
PDF
PDF
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
PDF
สมบัติบางประการของสารละลาย
PDF
อัตราการเกิดปฏิกิริยาเคมี
PDF
1 บทนำ แก๊สและสมบัติของแก๊ส
PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium
PPT
More Related Content
PDF
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
PDF
PPTX
PDF
PDF
PDF
What's hot
PDF
การคำนวณเกี่ยวกับสูตรเคมี
PDF
เคมีไฟฟ้า (Electrochemistry)
PDF
PDF
PDF
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
PDF
PDF
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 2
PDF
Lab 2 ปฏิกิริยาระหว่างกรดกับเบส
PDF
PDF
PDF
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
PDF
สมบัติบางประการของสารละลาย
PDF
อัตราการเกิดปฏิกิริยาเคมี
PDF
1 บทนำ แก๊สและสมบัติของแก๊ส
Viewers also liked
PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium
PPT
PDF
สื่อประกอบการสอนวิชาเคมีเพิ่มเติม3 ว30223 โดยครูนิติมา รุจิเรขาสุวรรณ
PDF
PDF
เอกสารประกอบการเรียนรู้ ว40223acids base1
PPT
PPT
PDF
PPT
PDF
PPT
PPT
PDF
PDF
Similar to Buffer h in
PDF
PDF
PPT
PPT
PDF
PPT
PPT
PDF
PDF
DOC
โจทย์อัตราการเกิดปฏิกิริยาเคมี
PPT
DOC
โจทย์อัตราการเกิดปฎิกิริยาเคมี
DOC
DOC
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย
DOC
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยากรดเบส
PDF
AnalChem: Complexometric titration
PPT
PPT
More from พัน พัน
PDF
PDF
PDF
ประวัติความเป็นมาของคอมพิวเตอร์
DOCX
การเปลี่ยนตัวเลขให้เป็นตัวอักษร
PDF
หลักการทำงาน บทบาทและอุปกรณ์พื้นฐานของคอมพิวเตอร์
PDF
รายงานเทคโนโลยีคอมพิวเตอร์
PDF
การทำงานพื้นฐานของคอมพิวเตอร์
PDF
PDF
ระบบคอมพิวเตอร์และยุคสมัย
PDF
PDF
PDF
เครือข่ายคอมพิวเตอร์เบื้องต้น
PDF
เรื่องคอมพิวเตอร์เบื้องต้น
PDF
PDF
PDF
PDF
PDF
PDF
PDF
Buffer h in 1. 2. สารละลายบัฟเฟอร์(Buffer solution)
เป็น solution ที่มีสมบัติในการต้านการเปลี่ยนแปลง pH ไม่ว่า
จะเติมกรดแก่หรือเบสแก่จานวนเล็กน้อยลงไป pH ของสารละลาย
ก็จะคงที่หรือเกือบคงที่
สารละลายบัฟเฟอร์ มี 2 ประเภท ได้แก่
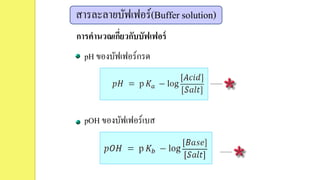
1. สารละลายบัฟเฟอร์กรด
เป็นสารละลายผสมระหว่างกรดอ่อนกับเกลือของกรดอ่อนนั้น
หรือกรดอ่อนกับคู่เบสของกรด เช่น CH3COOH กับ CH3COONa
3. สารละลายบัฟเฟอร์(Buffer solution)
ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์กรด
เช่น CH3COOH กับ CH3COONa
CH3COOH CH3COO- + H+
CH3COONa CH3COO- + Na+
ในสารละลายมี CH3COOH และ CH3COO- ทาหน้าที่รักษา pH ในสารละลาย
ถ้าเติมกรดแก่
CH3COOH CH3COO- + H+
H+ CH3COO- + H+ CH3COOH
H+ ที่ใส่ลงไปจะจับกับ CH3COO- ที่มีในสารละลายกลายเป็น CH3COOH ทาให้
[H+ ]เดิม คงที่ (pH ไม่เปลี่ยน) แต่ [CH3COO- ] ลดลงสมดุลจึงปรับไปข้างหน้า [H+]
เพิ่มขึ้นเล็กน้อย pH จึงลดลงเล็กน้อย
4. สารละลายบัฟเฟอร์(Buffer solution)
ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์กรด
ถ้าเติมเบสแก่
CH3COOH CH3COO- + H+
OH-
CH3COOH + OH- CH3COO- + H2O
OH- ที่ใส่ลงไปจะดึง H+ จาก CH3COOH ที่มีในสารละลาย เกิดเป็น CH3COO- ทา
ให้ [H+ ]เดิม คงที่ (pH ไม่เปลี่ยน) แต่ [CH3COOH] ลดลงสมดุลมีทิศย้อนกลับ [H+]
ลดลงเล็กน้อย pH เพิ่มขึ้นเล็กน้อย
2. สารละลายบัฟเฟอร์เบส
เป็นสารละลายผสมระหว่างเบสอ่อนกับเกลือของเบสอ่อนนั้น
หรือเบสอ่อนกับคู่กรดของเบส เช่น NH4OH กับ NH4Cl
(NH3 + H2O)
Note: เติมกรด เบสลดกรดเพิ่ม
5. ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์เบส
เช่น NH4OH กับ NH4Cl
NH4OH NH4
+ + OH-
NH4Cl NH4
+ + Cl-
ถ้าเติมกรดแก่
H+
NH4OH + H+ NH4
+ + H2O
H+ ที่ใส่ลงไป จะจับกับ NH4OH (NH3) ในสารละลายกลายเป็น NH4
+ ทาให้ [OH- ]คงที่
pH ไม่เปลี่ยน แต่ [NH4OH] ลดลงสมดุลจึงมีทิศย้อนกลับ [OH-] ลดลง pH ลดลงเล็กน้อย
สารละลายบัฟเฟอร์(Buffer solution)
ในสารละลายมี NH4OH และ NH4
+ ทาหน้าที่รักษา pH ในสารละลาย
NH3 + H2O NH4
+ + OH-
(NH3 + H2O)
6. ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์เบส
ถ้าเติมเบสแก่ OH-
NH4
+ + OH- NH4OH
OH- ที่เติมเข้าไปจะดึง H+ จาก NH4
+ ที่มีในสารละลายกลายเป็น
NH4OH ทาให้ [OH- ]คงที่ pH ไม่เปลี่ยน แต่ NH4
+ ลดลง สมดุลจึงมี
ทิศไปข้างหน้า OH- เพิ่มขึ้นเล็กน้อย pH เพิ่มขึ้นเล็กน้อย
สารละลายบัฟเฟอร์(Buffer solution)
NH3 + H2O NH4
+ + OH-
Exercise : อธิบายการต่อต้าน pH ของบัฟเฟอร์ H2S/HS-
เมื่อเติมกรดแก่และเบสแก่ลงไป
7. 8. สารละลายบัฟเฟอร์(Buffer solution)
สารละลายบัฟเฟอร์อาจเกิดจากสารละลายผสมอื่นๆ ได้ หากเมื่อสิ้นสุดปฏิกิริยาแล้ว
เหลือสารละลายกรดอ่อนและเกลือของกรดอ่อนหรือเบสอ่อนกับเกลือของเบสอ่อนนั้น
ตัวอย่าง สารละลายผสมระหว่าง กรดอ่อน + เบสแก่ เช่น
CH3COOH 3 M 10 mL กับ NaOH 1 M 10 mL เป็นบัฟเฟอร์หรือไม่?
วิธีทา CH3COOH + NaOH CH3COONa + H2O
มี 30 mmol 10 mmol - ไม่คิด
ใช้ -10 mmol -10 mmol +10 mmol
เหลือ 20 mmol 0 +10 mmol -
เมื่อปฏิกิริยาสิ้นสุด จะเหลือกรดอ่อน ( CH3COOH 20 mmol) และเกลือของ
กรดอ่อน ( CH3COO- 10 mmol) จึงสรุปได้ว่า สารละลายผสมข้างต้นเป็นสารละลาย
บัฟเฟอร์
Ex สารละลายผสมระหว่าง CH3COOH 3 M 10 mL กับ NaOH 1 M 30 mL
เป็นบัฟเฟอร์หรือไม่ เพราะเหตุใด?
9. สารละลายบัฟเฟอร์(Buffer solution)
Exercise: พิจารณาว่าสารละลายต่อไปนี้คู่ใดเป็นบัฟเฟอร์
1. KH2PO4/H3PO4
2. NaClO4/HClO4
3. NaOH 1 mol / CH3COOH 2 mol
4. HNO2 1 M 20 mL กับ NaOH 1 M 10 mL
5. HCN 2 M 20 mL กับ KOH 1 M 40 mL
6. HF 1 M 30 mL กับ LiOH 2 M 30 mL
7. KCN 2 M 10 mL กับ HI 1 M 10 mL
8. CH3COOH 0.2 M 40 mL กับ CH3COONa 0.2 M 10 mL
9. KNO2 0.05 M 5 mL กับ HNO2 0.05 M 10 mL
10. NH4Cl 2 M 10 mL กับ KOH 2 M 20 mL
11. LiCN 3 M 40 mL กับ LiF 1 M 20 mL
10. 11. 12. สารละลายบัฟเฟอร์(Buffer solution)
Example1 หา pOH และ pH ของสารละลาย NH3 เข้มข้น 0.2 M
และ NH4Cl เข้มข้น 0.1 M ( Kb ของ NH3 = 1.8x10-5)
Example2 จงหาอัตราส่วนของ A- และ HA ที่ทาให้สารละลายมี pH = 4
( Ka ของ HA = 1x10-4)
pOH = 4.74 - 0.3 = 4.44
pH = 14 – 4.44 = 9.56
13. สารละลายบัฟเฟอร์(Buffer solution)
Exercise1 หา pH ของสารละลายต่อไปนี้
1) 0.6 M NH3 และ 0.6 M NH4Cl (Kb = 1.8x10-5)
2) 0.6 M CH3COOH และ 0.2 M CH3COONa (Ka = 1.8x10-5)
Exercise2 หาอัตราส่วน NH4Cl และ NH3 ที่ใช้เตรียมบัฟเฟอร์ pH=9
(Kb = 1.8x10-5)
Exercise3 หา pH ของสารละลายผสม HNO2 2 mol กับ NaOH 2 mol
ในสารละลาย 1 L และหา pH ของสารละลายผสมที่ลด NaOH เหลือ
1 mol ในสารละลาย 1 L (Ka ของ HNO2 = 1x10-4)
Exercise4 หา pH ของบัฟเฟอร์ผสมระหว่าง NH3 เข้มข้น 0.5 M ปริมาตร
300 cm3 และ NH4Cl 0.5 M ปริมาตร 200 cm3 (Kb ของ NH3 = 1.8x10-5)
(pH = 9.26)
(pH = 4.26)
([เบส]/[เกลือ] = 0.55)
(9.15, 4)
(9.44)
14. 15. สารละลายบัฟเฟอร์(Buffer solution)
การคานวณ pH ของสารละลายบัฟเฟอร์ที่เปลี่ยนแปลงเมื่อเติมกรดหรือเบสลงไป
จะต้องหา [ ] ของกรดหรือเบส และเกลือที่เปลี่ยนแปลงหลังเติมกรด
หรือเบสลงไป แล้วแทนค่าในสูตร
Example1:
ก.หา pH ของสารละลายผสม CH3COOH เข้มข้น 0.1 M และ
CH3COONa 0.1 M (Ka ของ CH3COOH = 1.8x10-5 )
ข. ถ้าเติม HCl ลงไป 0.01 mol ในบัฟเฟอร์ 1 L
ค. ถ้าเติม NaOH ลงไป 0.01 mol ในบัฟเฟอร์ 1 L
Exercise: ก. หา pH ของบัฟเฟอร์ NH3 เข้มข้น 0.5 M ปริมาตร 300 cm3
และ NH4Cl เข้มข้น 0.5 M ปริมาตร 200 cm3 (Kb ของ NH3 = 1.8x10-5)
ข. หา pH เมื่อเติม HCl 0.05 mol ลงในบัฟเฟอร์ ก ปริมาตร 1 L
16. 17. 18. 19. อินดิเคเตอร์ (Indicator)
อธิบาย หากสารละลายมี pH
pH ≤ 4.2 จะทาให้อินดิเคเตอร์ มีสีแดง
4.2 ≤ pH ≤ 6.0 จะทาให้อินดิเคเตอร์ มีสีส้ม
pH ≥ 6.0 จะทาให้อินดิเคเตอร์ มีสีเหลือง
pH = (4.2+6)/2 = 5.1 จะเรียกว่าจุดยุติ (end point)ของการไทเทรต
ถือเป็นจุดที่อินดิเคเตอร์เปลี่ยนสี
20. อินดิเคเตอร์ (Indicator)
HIn H+ + In-
โดยทั่วไป ≥ 10 indicator จะมีสีกรด (HIn)
≥ 10 indicator จะมีสีเบส (In-)
[HIn] = [In-] Indicator จะมีสีผสม
การแตกตัวของ indicator
21. อินดิเคเตอร์ (Indicator)
Example1 ลิตมัสมีค่าคงที่สมดุล = 10-7 โดยรูปกรดจะมีสีแดง
รูปเบสจะมีสีน้าเงินในสารละลาย pH = 5, pH = 7 และ pH = 8
จะเห็นสีอะไร
Example2 อินดิเคเตอร์ A มี Ka = 1 x 10-6 เมื่อ
= 1 สีม่วง, ≥ 10 สีแดง, ≥ 10 สีน้าเงิน
หาช่วง pH ที่อินดิเคเตอร์เปลี่ยนสี
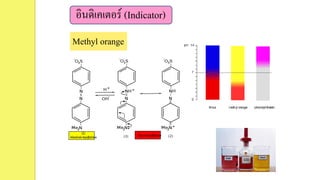
Example3 methyl orange มี pKa = 3.5 มีสีแดงในกรดและสีส้ม
ในเบส ในสารละลายที่มี [H+] = 2.1 x 10-3 จะมีสีใด
22. อินดิเคเตอร์ (Indicator)
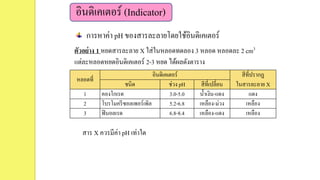
การหาค่า pH ของสารละลายโดยใช้อินดิเคเตอร์
หลอดที่
อินดิเคเตอร์ สีที่ปรากฏ
ในสารละลาย Xชนิด ช่วง pH สีที่เปลี่ยน
1 คองโกเรด 3.0-5.0 น้าเงิน-แดง แดง
2 โบรโมครีซอลเพอร์เพิล 5.2-6.8 เหลือง-ม่วง เหลือง
3 ฟินอลเรด 6.8-8.4 เหลือง-แดง เหลือง
ตัวอย่าง 1 หยดสารละลาย X ใส่ในหลอดทดลอง 3 หลอด หลอดละ 2 cm3
แต่ละหลอดหยดอินดิเคเตอร์ 2-3 หยด ได้ผลดังตาราง
สาร X ควรมีค่า pH เท่าใด
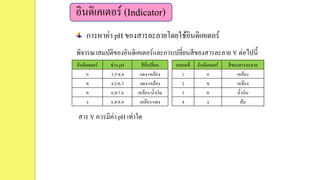
23. อินดิเคเตอร์ (Indicator)
การหาค่า pH ของสารละลายโดยใช้อินดิเคเตอร์
พิจารณาสมบัติของอินดิเคเตอร์และการเปลี่ยนสีของสารละลาย Y ต่อไปนี้
อินดิเคเตอร์ ช่วง pH สีที่เปลี่ยน
ก 3.2-4.4 แดง-เหลือง
ข 4.2-6.3 แดง-เหลือง
ค 6.0-7.6 เหลือง-น้าเงิน
ง 6.8-8.4 เหลือง-แดง
หลอดที่ อินดิเคเตอร์ สีของสารละลาย
1 ก เหลือง
2 ข เหลือง
3 ค น้าเงิน
4 ง ส้ม
สาร Y ควรมีค่า pH เท่าใด
24. พิจารณาสมบัติของอินดิเคเตอร์ต่อไปนี้
อินดิเคเตอร์ (Indicator)
การหาค่า pH ของสารละลายโดยใช้อินดิเคเตอร์
อินดิเคเตอร์ ช่วง pH สีที่เปลี่ยน
A 4.2-6.3 แดง-เหลือง
B 6.0-7.6 เหลือง-น้าเงิน
C 9.4-10.6 ไม่มีสี-น้าเงิน
เมื่อนาสารละลายที่ได้จากการทาปฏิกิริยาพอดีระหว่างกรดกับเบสคู่หนึ่งมาหาค่า pH
พบว่า เมื่อหยดอินดิเคเตอร์ A ได้สารละลายมีสีเหลือง หยดอินดิเคเตอร์ B สารละลายมีสี
น้าเงิน และหยดอินดิเคเตอร์ C ได้สารละลายไม่มีสี สารละลายกรด-เบสที่ใช้ในข้อใด
เป็นไปได้
ก. HCl, NaOH ข. H2SO4, Ba(OH)2
ค. CH3COOH, NaOH ง. HNO3, NH4OH
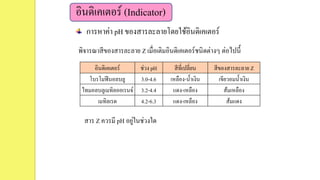
25. อินดิเคเตอร์ (Indicator)
การหาค่า pH ของสารละลายโดยใช้อินดิเคเตอร์
พิจารณาสีของสารละลาย Z เมื่อเติมอินดิเคเตอร์ชนิดต่างๆ ต่อไปนี้
อินดิเคเตอร์ ช่วง pH สีที่เปลี่ยน สีของสารละลาย Z
โบรโมฟีนอลบลู 3.0-4.6 เหลือง-น้าเงิน เขียวอมน้าเงิน
ไทมอลบลูเมทิลออเรนจ์ 3.2-4.4 แดง-เหลือง ส้มเหลือง
เมทิลเรด 4.2-6.3 แดง-เหลือง ส้มแดง
สาร Z ควรมี pH อยู่ในช่วงใด


![สารละลายบัฟเฟอร์(Buffer solution)
ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์กรด
เช่น CH3COOH กับ CH3COONa
CH3COOH CH3COO- + H+
CH3COONa CH3COO- + Na+
ในสารละลายมี CH3COOH และ CH3COO- ทาหน้าที่รักษา pH ในสารละลาย
ถ้าเติมกรดแก่
CH3COOH CH3COO- + H+
H+ CH3COO- + H+ CH3COOH
H+ ที่ใส่ลงไปจะจับกับ CH3COO- ที่มีในสารละลายกลายเป็น CH3COOH ทาให้
[H+ ]เดิม คงที่ (pH ไม่เปลี่ยน) แต่ [CH3COO- ] ลดลงสมดุลจึงปรับไปข้างหน้า [H+]
เพิ่มขึ้นเล็กน้อย pH จึงลดลงเล็กน้อย](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-3-320.jpg)
![สารละลายบัฟเฟอร์(Buffer solution)
ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์กรด
ถ้าเติมเบสแก่
CH3COOH CH3COO- + H+
OH-
CH3COOH + OH- CH3COO- + H2O
OH- ที่ใส่ลงไปจะดึง H+ จาก CH3COOH ที่มีในสารละลาย เกิดเป็น CH3COO- ทา
ให้ [H+ ]เดิม คงที่ (pH ไม่เปลี่ยน) แต่ [CH3COOH] ลดลงสมดุลมีทิศย้อนกลับ [H+]
ลดลงเล็กน้อย pH เพิ่มขึ้นเล็กน้อย
2. สารละลายบัฟเฟอร์เบส
เป็นสารละลายผสมระหว่างเบสอ่อนกับเกลือของเบสอ่อนนั้น
หรือเบสอ่อนกับคู่กรดของเบส เช่น NH4OH กับ NH4Cl
(NH3 + H2O)
Note: เติมกรด เบสลดกรดเพิ่ม](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-4-320.jpg)
![ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์เบส
เช่น NH4OH กับ NH4Cl
NH4OH NH4
+ + OH-
NH4Cl NH4
+ + Cl-
ถ้าเติมกรดแก่
H+
NH4OH + H+ NH4
+ + H2O
H+ ที่ใส่ลงไป จะจับกับ NH4OH (NH3) ในสารละลายกลายเป็น NH4
+ ทาให้ [OH- ]คงที่
pH ไม่เปลี่ยน แต่ [NH4OH] ลดลงสมดุลจึงมีทิศย้อนกลับ [OH-] ลดลง pH ลดลงเล็กน้อย
สารละลายบัฟเฟอร์(Buffer solution)
ในสารละลายมี NH4OH และ NH4
+ ทาหน้าที่รักษา pH ในสารละลาย
NH3 + H2O NH4
+ + OH-
(NH3 + H2O)](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-5-320.jpg)
![ระบบการต่อต้านการเปลี่ยนแปลง pH ของบัฟเฟอร์เบส
ถ้าเติมเบสแก่ OH-
NH4
+ + OH- NH4OH
OH- ที่เติมเข้าไปจะดึง H+ จาก NH4
+ ที่มีในสารละลายกลายเป็น
NH4OH ทาให้ [OH- ]คงที่ pH ไม่เปลี่ยน แต่ NH4
+ ลดลง สมดุลจึงมี
ทิศไปข้างหน้า OH- เพิ่มขึ้นเล็กน้อย pH เพิ่มขึ้นเล็กน้อย
สารละลายบัฟเฟอร์(Buffer solution)
NH3 + H2O NH4
+ + OH-
Exercise : อธิบายการต่อต้าน pH ของบัฟเฟอร์ H2S/HS-
เมื่อเติมกรดแก่และเบสแก่ลงไป](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-6-320.jpg)



![สารละลายบัฟเฟอร์(Buffer solution)
การคานวณเกี่ยวกับบัฟเฟอร์
พิจารณาการแตกตัวของกรดอ่อน
HA H+ + A-
=
take -log : -log [H+] = -log](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-10-320.jpg)

![สารละลายบัฟเฟอร์(Buffer solution)
Exercise1 หา pH ของสารละลายต่อไปนี้
1) 0.6 M NH3 และ 0.6 M NH4Cl (Kb = 1.8x10-5)
2) 0.6 M CH3COOH และ 0.2 M CH3COONa (Ka = 1.8x10-5)
Exercise2 หาอัตราส่วน NH4Cl และ NH3 ที่ใช้เตรียมบัฟเฟอร์ pH=9
(Kb = 1.8x10-5)
Exercise3 หา pH ของสารละลายผสม HNO2 2 mol กับ NaOH 2 mol
ในสารละลาย 1 L และหา pH ของสารละลายผสมที่ลด NaOH เหลือ
1 mol ในสารละลาย 1 L (Ka ของ HNO2 = 1x10-4)
Exercise4 หา pH ของบัฟเฟอร์ผสมระหว่าง NH3 เข้มข้น 0.5 M ปริมาตร
300 cm3 และ NH4Cl 0.5 M ปริมาตร 200 cm3 (Kb ของ NH3 = 1.8x10-5)
(pH = 9.26)
(pH = 4.26)
([เบส]/[เกลือ] = 0.55)
(9.15, 4)
(9.44)](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-13-320.jpg)

![สารละลายบัฟเฟอร์(Buffer solution)
การคานวณ pH ของสารละลายบัฟเฟอร์ที่เปลี่ยนแปลงเมื่อเติมกรดหรือเบสลงไป
จะต้องหา [ ] ของกรดหรือเบส และเกลือที่เปลี่ยนแปลงหลังเติมกรด
หรือเบสลงไป แล้วแทนค่าในสูตร
Example1:
ก.หา pH ของสารละลายผสม CH3COOH เข้มข้น 0.1 M และ
CH3COONa 0.1 M (Ka ของ CH3COOH = 1.8x10-5 )
ข. ถ้าเติม HCl ลงไป 0.01 mol ในบัฟเฟอร์ 1 L
ค. ถ้าเติม NaOH ลงไป 0.01 mol ในบัฟเฟอร์ 1 L
Exercise: ก. หา pH ของบัฟเฟอร์ NH3 เข้มข้น 0.5 M ปริมาตร 300 cm3
และ NH4Cl เข้มข้น 0.5 M ปริมาตร 200 cm3 (Kb ของ NH3 = 1.8x10-5)
ข. หา pH เมื่อเติม HCl 0.05 mol ลงในบัฟเฟอร์ ก ปริมาตร 1 L](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-15-320.jpg)



![อินดิเคเตอร์ (Indicator)
HIn H+ + In-
โดยทั่วไป ≥ 10 indicator จะมีสีกรด (HIn)
≥ 10 indicator จะมีสีเบส (In-)
[HIn] = [In-] Indicator จะมีสีผสม
การแตกตัวของ indicator](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-20-320.jpg)
![อินดิเคเตอร์ (Indicator)
Example1 ลิตมัสมีค่าคงที่สมดุล = 10-7 โดยรูปกรดจะมีสีแดง
รูปเบสจะมีสีน้าเงินในสารละลาย pH = 5, pH = 7 และ pH = 8
จะเห็นสีอะไร
Example2 อินดิเคเตอร์ A มี Ka = 1 x 10-6 เมื่อ
= 1 สีม่วง, ≥ 10 สีแดง, ≥ 10 สีน้าเงิน
หาช่วง pH ที่อินดิเคเตอร์เปลี่ยนสี
Example3 methyl orange มี pKa = 3.5 มีสีแดงในกรดและสีส้ม
ในเบส ในสารละลายที่มี [H+] = 2.1 x 10-3 จะมีสีใด](https://image.slidesharecdn.com/bufferhin-160210031946/85/Buffer-h-in-21-320.jpg)