Recommended
PDF
5 ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
PDF
1 ความหมายอัตราการเกิดปฏิกิริยาเคมี
PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี
PDF
ชุดกิจกรรมการเรียนรู้ เรื่องอัตราการเกิดปฏิกิริยาเคมี
PDF
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
PPT
PDF
PDF
Microsoft power point ปฏิกิริยาเคมี
PDF
PPTX
PDF
แบบทดสอบ วิทยาศาสตร์ 2 ชั้น ม.1 ชุดที่ 1
PDF
ใบความรู้เรื่องเซลล์ของสิ่งมีชีวิต1
PDF
PDF
PDF
บทที่ 1 ความรู้เกี่ยวกับพลังงาน (2)
PDF
PDF
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PPT
PDF
กล้องจุลทรรศน์ (Microscope)
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PPTX
PDF
PDF
PPT
PPT
อัตราการเกิดปฏิกิริยาเคมี
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี
More Related Content
PDF
5 ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี
PDF
1 ความหมายอัตราการเกิดปฏิกิริยาเคมี
PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี
PDF
ชุดกิจกรรมการเรียนรู้ เรื่องอัตราการเกิดปฏิกิริยาเคมี
PDF
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
PPT
What's hot
PDF
PDF
Microsoft power point ปฏิกิริยาเคมี
PDF
PPTX
PDF
แบบทดสอบ วิทยาศาสตร์ 2 ชั้น ม.1 ชุดที่ 1
PDF
ใบความรู้เรื่องเซลล์ของสิ่งมีชีวิต1
PDF
PDF
PDF
บทที่ 1 ความรู้เกี่ยวกับพลังงาน (2)
PDF
PDF
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PPT
PDF
กล้องจุลทรรศน์ (Microscope)
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PPTX
PDF
PDF
PPT
Viewers also liked
PPT
อัตราการเกิดปฏิกิริยาเคมี
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี
PPT
อัตราการเกิดปฏิกิริยาเคมี (Rate of reaction
PDF
บทที่ 6 อัตราการเกิดปฏิกิริยา
PDF
PDF
Microsoft power point ปิโตรเลียม
Similar to อัตราการเกิดปฏิกิริยาเคมี
PPT
ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา
PDF
ปัจจัยที่มีผลต่อการเกิดอัตราปฏิกิริยาเคมี เล่ม4
PDF
ตัวเร่งและตัวหน่วงปฏิกิริยาเคมี เล่ม7
PPT
2 กฎอัตราและอันดับของปฏิกิริยา
PDF
การเกิดปฏิกิริยาเคมี เล่ม1
PDF
ชุดกิจกรรมวิทยาศาสตร์ เรื่อง ปฏิกิริยาเคมี รายวิชาเคมีพื้นฐาน ชั้นมัธยมศึก...
PDF
PDF
ใบงานปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา
PDF
ชุดกิจกรรมวิทยาศาสตร์ เรื่อง ปฏิกิริยาเคมี รายวิชาเคมีพื้นฐาน กลุ่มสาระก...
DOC
PPT
PDF
PPT
PPT
DOC
อัตราการเกิดปฎิกิริยาเคมี
DOC
DOC
PDF
DOC
PPT
More from Jariya Jaiyot
PDF
แบบทดสอบ เรื่อง การถ่ายทอดลักษณะทางพันธุกรรม
PDF
กระบวนการถ่ายทอดลักษณะทางพันธุกรรม
PDF
แบบทดสอบ บทที่ 1 ปฏิสัมพันธ์ในระบบสุริยะ
PDF
แบบทดสอบ เรืื่องพอลิเมอร์
PDF
PDF
บทที่ 3 เครื่องสำอางในชีวิตประจำวัน
PDF
Lab 2 ปฏิกิริยาระหว่างกรดกับเบส
PDF
แบบฝึกการหาอัตราเร็วความเร็ว
PDF
ปัจจัยที่มีผลต่อสมดุลเคมี ปี 57
PDF
การกัดกร่อนของโลหะและการป้องกัน
PDF
PDF
PDF
PDF
PDF
PDF
PDF
PDF
PDF
โครงการแผนที่ออนไลน์ป่าชุมชนอำเภอเวียงสา : กรณีศึกษา ป่าชุมชนบ้านบุญเรือง
PPTX
อัตราการเกิดปฏิกิริยาเคมี 1. 2. 3. 4. ตัวอย่าง ปฏิกิริยา aA + bB cC + dD
จงหาอัตราการลดลงของสารตั้งต้น
อัตราการลดลงของสาร A =
อัตราการลดลงของสาร B =
จงหาอัตราการเพิ่มขึ้นของของสารผลิตภัณฑ์
อัตราการเพิ่มขึ้นของสาร C =
อัตราการเพิ่มขึ้นของสาร D =
t
C
][
t
D
][
t
A
][
t
B
][
6. ตัวอย่าง ปฏิกิริยา aA + bB cC + dD
อัตราการเกิดปฏิกิริยา = =
t
A
a
][1
t
B
b
][1
t
C
c
][1
t
D
d
][1
=
=
7. 8. 9. 10. 11. 12. 13. ทฤษฏีการชน (Collision Theory) อธิบายว่า “ปฏิกิริยาเคมีเกิดขึ้น
ได้ก็ต่อเมื่ออนุภาคของสารเข้าทาปฏิกิริยากันจะต้องมีการชนกัน
เสียก่อน” และการชนกันต้องมีลักษณะดังนี้
1. อนุภาคของสารตั้งต้นต้องมีการชนกัน
2. อนุภาคที่ชนจะต้องมีพลังงานสูงพอ คือ สูงพอที่จะทาลาย
พันธะเก่าแล้วเกิดพันธะใหม่ได้
3. ต้องชนได้ทิศทางที่เหมาะสม
2 แนวคิดการเกิดปฏิกิริยาเคมี
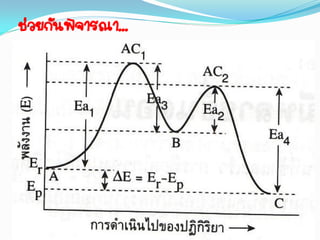
16. 3) พลังงานก่อกัมมันต์( Ea ) ของปฏิกิริยา
- เป็นพลังงานต่่าที่สุดที่ท่าให้เกิดปฏิกิริยาได้ ถ้ามีพลังงานต่่ากว่านี้ก็
จะไม่เกิดปฏิกิริยา
- ถ้าพลังงานจลน์หลังการชนมากกว่าหรือเท่ากับพลังงานก่อกัมมันต์
ปฏิกิริยาก็เกิดขึ้นได้สารผลิตภัณฑ์
17. 18. 19. 20. 21. สรุป
E1 = พลังงานของสารตั้งต้น ( Er )
E3 = พลังงานของผลิตภัณฑ์ ( Ep )
Ea = พลังงานก่อกัมมันต์(พลังงานกระตุ้น)
Ea = E2 – E1
E = พลังงานของปฏิกิริยา (H)
E = E3 – E1 หรือ E = Ep – Er
E ลบ คาย
E บวกดูด
22. 23. 24. 25. 27. 29. 30. 31. 33. 34. 35. 36. 37. 38. 39. 41. 44. 48.



![ตัวอย่าง ปฏิกิริยา aA + bB cC + dD
จงหาอัตราการลดลงของสารตั้งต้น
อัตราการลดลงของสาร A =
อัตราการลดลงของสาร B =
จงหาอัตราการเพิ่มขึ้นของของสารผลิตภัณฑ์
อัตราการเพิ่มขึ้นของสาร C =
อัตราการเพิ่มขึ้นของสาร D =
t
C
][
t
D
][
t
A
][
t
B
][](https://image.slidesharecdn.com/random-130602102615-phpapp01/85/slide-4-320.jpg)

![ตัวอย่าง ปฏิกิริยา aA + bB cC + dD
อัตราการเกิดปฏิกิริยา = =
t
A
a
][1
t
B
b
][1
t
C
c
][1
t
D
d
][1
=
=](https://image.slidesharecdn.com/random-130602102615-phpapp01/85/slide-6-320.jpg)