Recommended
PDF
PDF
PDF
PDF
PDF
PDF
การคำนวณเกี่ยวกับสูตรเคมี
PDF
บทที่ 3 ปริมาณสารสัมพันธ์
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
หน่วยที่ 4 สูตรเคมี (point)
PDF
PDF
PDF
ใบความรู้ เรื่อง การทำนายรูปร่างโมเลกุลโคเวเลนต์
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 2
PDF
ปริมาณสารสัมพันธ์ - Stoichiometry
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
PDF
PDF
PDF
แบบทดสอบ วิทยาศาสตร์ 2 ชั้น ม.1 ชุดที่ 2
PDF
PDF
PDF
PDF
DOCX
แบบทดสอบปลายภาคเรียน วิทย์ 5 2558
PDF
PDF
PDF
PDF
PDF
More Related Content
PDF
PDF
PDF
PDF
PDF
PDF
การคำนวณเกี่ยวกับสูตรเคมี
PDF
บทที่ 3 ปริมาณสารสัมพันธ์
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
What's hot
PDF
หน่วยที่ 4 สูตรเคมี (point)
PDF
PDF
PDF
ใบความรู้ เรื่อง การทำนายรูปร่างโมเลกุลโคเวเลนต์
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 2
PDF
ปริมาณสารสัมพันธ์ - Stoichiometry
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
PDF
PDF
PDF
แบบทดสอบ วิทยาศาสตร์ 2 ชั้น ม.1 ชุดที่ 2
PDF
PDF
PDF
PDF
DOCX
แบบทดสอบปลายภาคเรียน วิทย์ 5 2558
PDF
PDF
PDF
Similar to โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย
PDF
PDF
PDF
PDF
DOC
PDF
PDF
ข้อสอบเอ็นทรานซ์ เคมี มีนาคม 2546
PPT
DOC
PDF
DOC
โจทย์อัตราการเกิดปฏิกิริยาเคมี
PPT
PPT
PDF
Quemarch48 130814115357-phpapp02
PDF
1.เก็งข้อสอบ a net วิชาเคมี ชุดที่ 1
PDF
PPT
PDF
PDF
PDF
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย 1. 2. H=1 C=12
N=14
O=16 Na=23
Mg=24
P=31 S = 32
Ca=40
Cl=35.5 Cr=52
Fe=56
Cu=63.5 Sb=122
I=127
ตอนที่ 1 ข้อ 1 / 50
1. ปัจจัยใดต่อไปนี้มีผลต่อความดันไอของของเหลว
1. แรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว
2. ปริมาณของของเหลวซึ่งมีสมดุลของของเหลวและไอ
3. อุณหภูมิของของเหลว
1. ก เท่านั้น 2. ก และ ข เท่านั้น 3. ก และ ค เท่านั้น 4. ก, ข
และ ค
2. ข้อมูลแสดงค่าพลังงานที่เกี่ยวข้องกับการละลายของสาร A , B และ C เป็นดังนี้
สาร พลังงานไฮเดรชัน ( kJ / พลังงานแลตทิซ ( kJ /
mol ) mol )
A 745 750
B 590 550
C 690 700
ถ้าใช้สาร A , B และ C จำานวนโมลเท่ากันละลายในนำ้าที่มีปริมาตร 100Ccm3 การ
เปรียบเทียบ
อุณหภูมิของแต่ละสารละลาย ข้อใดถูก
1. A > B > C 2. B > A > C 3. B > C > A
4. C > A > B
3. นักเรียนผู้หนึ่งทำาการททดลองเกี่ยวกับสมบัติของสารละลายพบว่าตัวทำาละลาย X มีจุดเยือกแข็งที่
5. 5 o C
นำาสารประกอบ X 0 . 2 โมล มาละลายในตัวทำาละลาย X 100 cm
3
พบว่าจุดเยือกแข็ง
เปลี่ยนเป็น
-4.3 o
C
ถ้านำาสารประกกอบ Z 8.4 g. มาละลายในตัวทำาละลาย X 50 cm3
จุดเยือกแข็งขอองสาร
ละลายเป็น –4.3
o
C เช่นเดียวกันถ้าสารประกอบ Z ประกอบด้วยธาตุคาร์บอนร้อยละ
85.71 ธาตุ
ไฮโดรเจนร้อยละ 14.29 โดยโมล สูตรโมเลกุลของสารประกอบนี้จะเป็นดังข้อใด
3. 1. C6H6 2. C6 H12 3. C 9H8
4. C9 H14
4. ถ้าการแยกสารด้วยวิธีโครมาโทกราฟโดยใช้กระดาษกรองเป็นตัวดูดซับได้ผลดังนี้
จุด X = สาร A บริสทธิ์
ุ
จุด y= สารตัวอย่างประกอบ
ด้วยสาร A และสาร B
ข้อสรุปใดน่าจะเป็นไปได้
ก. สาร A และสาร B มีค่า Rf เท่ากัน จึงแยกสาร A และ B ออกจากกันไม่ได้ด้วยวิธี
การนี้
2.สาร B อาจเป็นสารไม่มีสี จึงควรตรวจสมบัติตอไปโดยผ่านแสงอัลตราไวโอเลต
่
3.สาร A และสาร B เคลือนที่ไปบนตัวดูดซับได้ใกล้เคียงกัน จึงควรทำาการทดลองซำ้าโดย
่
เปลี่ยน
ตัวทำาละลาย
1. ก เท่านั้น 2. ข เท่านั้น 3. ก และ ข 4.
ข และ ค
5. แร่ตัวอย่างหนัก 1.12 g. นำามาวิเคราะห์หาปริมาณ Fe ( ΙΙΙ ) โดยทำาปฏิกิรยากับ
ิ
สารละลาย KΙ
ความเข้มข้น 1 mol / dm-3 ปริมาตร 10 cm3 เกิดแก็ส Ι 2 44.8 cm3 ที่
STP ปฏิกิริยาเกิดขึ้นดัง
สมการ Fe ( ΙΙΙ ) + 2 Ι( aq ) → FeΙΙΙ ) + Ι 2 ( g )
(
แร่ตัวอย่างนี้มีเหล็กในรูป Fe ( ΙΙΙ ) อยู่ร้อยละเท่าใดโดยมวล
1. 10 2. 25 3. 50
4. 100
6.ปฏิกิริยาระหว่างสารประกอบ สมมติ A และ B เป็นดังสมการ
A + 3B → 4C
จากการทดลองเพื่อการทดสอบประสิทธิภาพของปฏิกิริยานี้ พบว่าร้อยละของผลได้ มีค่า 75
%
ถ้าต้องการเตรียมสารประกอบ C 6 โมล จะต้องใช้ A และ B
A B
1. 1 3
2. 1.1 3.3
4. 3. 1.5 4.5
4. 2 6
7. ข้อใดถูก
สูตรเคมี นำ้าหนักสาร จำานวนโมเลกุล ชนิดของสารประกอบ
1. NO2 2.3 0.05 x โคเวเลนต์
โคเวเลนต์
2. N ( CH3)3 1.18 1023 ไอออนิก
3. NaCl 5.85 1.2 ไอออนิก
4. H2SO4 4.9 x 10 22
2 x 1022
0.10 x
1023
8. โลหะ A 2 mol ถูกยิงด้วยอนุภาค จนอิเล็กตรอนกระเด็นออกไปเกิดเป็น A3+ ไอออน
ร้อยละ 0.10
อิเล็กตรอน ทีกระเดนออกไปมีจำานวนเท่าใด
่
1 . 1.8 X 1021 2. 3.6 X 10 21
3. 1.2 X 1024 4. 3.6X 1024
9. พิจารณาตารางข้อมูลต่อไปนี้
ΙE พลังงานไอออไนเซชัน ( MJ / moI-1 )
ธาตุ ΙE 1 ΙE 2 ΙE 3 ΙE 4 ΙE 5 ΙE 6 ΙE 7 ΙE 8 Ι E 9 Ι E 10 Ι E 11
X 1.7 3.4 6.1 8.4 11. 15. 17. 92. 106
0 2 9 1 .4
Y 0.5 4.6 6.9 9.6 13. 16. 20. 25. 28. 141 159
4 6 1 5 9 .4 .1
ข้อสรุปใดผิด
1. อิเล็กตรอนในระดับพลังงาน n= 1 ของ X ต้องคายพลังงาน 90.15 MJ / mol
เพื่อจะไปอยูที่ระดับ
่
พลังงาน n =2
2. ผลต่างของระดับภพลังงาน n=2 และ n = 1 ใน Y จะมากกว่าใน X
3. ธาตุ X เป็นธาตุหมู่เดียวกับ 53 Ι
4. สาประกอบระหว่าง Y กับ X เป็นสารประกอบไอออนิก
10.พิจารณาแผนภาพต่อไปนี้
รูปใดแสดงการจัดเรียงอิเล็กตรอนในสภาวะพื้นของอะตอมไม่ถกต้อง
ู
5. 1. 1 และ 2 เท่านั้น 2. และ 3 เท่านั้น 3. 1 และ 3 เท่านั้น 4.
1 , 2 และ
11. X , Y และ Z ดังนี้
กำาหนดข้อมูลของธาตุ
Ι ธาตุ X มี ΙΕ 1 < ΙΕ 2 << ΙΕ 3
ΙΙ ธาตุ Y มี เป็นธาตุหมู่เดียวกับ 13AI
ΙΙΙ ไอโซโทปหนึ่งของธาตุ Z ไม่มีนิวตรอน
สูตรของสารประกอบซัลไฟด์ของ X และ Y , Z ควรเป็นข้อใด
1. X S Y2S3 Z2S 2. XS Y2S3 ZS 3. XS Y3S2 ZS
4. XS Y3S2 Z2S
12. ธาตุสมมติ X2 . 17 Y และ 35Z มีสตรโมเลกุลเป็น
ู x2 Y2 และ Z 2 ตามลำาดับ เกิด
สารประกอบไอออนิก
กับโพแทสเซียม เมือพิจารณาผลการทดลองต่อไปนี้
่
Ι เมื่อนำาสารละลาย KX มาทำาปฏิกิริยากับ Y2 พบว่าไม่เกิดการเปลี่ยนแปลง
ΙΙ เมือนำาสารละสาย KZ มาทำาปฏิกิริยากับ Y2 พบว่าจะได้ Z2 เกิดขึ้น
่
ข้อสรุปใดถูกต้อง
1. X เป็นตัวรีดิวซ์ที่ดกว่า Y และ Z
ี
2. เมื่อผสมสารละสาย KY กับ X2 จะไม่มการเปลี่ยนแปลงใดเกิดขึ้น
ี
3. เวเลนซ์ อิเล็กตรอนของ X หลุดได้ง่ายกว่าเวเลนซ์อิเล็กตรอนของ Y-
-
และของ Z-
4. เมื่อผสมสารละลาย KZ กับ X-2 จะเกิด Z 2 และ KX ขึ้น
13. ในการละสายตัวของ
238
U92 ประกอบด้วยขั้นตอนต่าง ๆ 14 ขั้นตอน แต่ละขั้นตอนให้
อนุภาคต่าง
ตามลำาดับดังนี้ .β βαα α α α β α β β β และ ผลผลิตในขั้น
ตอนที่ 14 คือ
ข้อใด
210 206
1. 222
Rn
86 2. 84 Po 3. 82 Pb
206
4. 76 Os
14.การเปรียบเทียบจำานวนอิเล็กตรอนคู่โดดเดียวของอะตอมกลางต่อไปนี้
่ ข้อใดถูก
1. NH3>NO 3>ClO 4 - -
2. NCl3>NO3-
>ClF3
3. ClO4->ClO-3>NO-3 4.
ClF3>NCl3>ClO-3
15.สารประกอบทีเกิดจากการรวมตัวของธาตุหมู่ต่าง ๆ ต่อไปนี้ ข้อใดมีรายละเอียดถูกต้อง (เลขอะตอม
ของธาตุทั้งหมดตำ่ากว่า 50 )
6. หมู่ของธาตุ
ที่เป็นองค์ อัตราส่วนอะตอม จุดเดือด การละลายนำ้า/สมบัติ
ประกอบ
1. I กับ VI 1:2 สูง ละลาย/เบส
ตำ่า
2. V กับ VI 2:3 ตำ่า ละลาย/กรด
3. II กับ VII 1:2 สูง ละลาย/กลาง
4. II กับ IV 1:1 ไม่ละลาย
16.กำาหนค่าอิเล็กโทรเนกาติวิตี (E.N) ของอะตอมบางชนิด
อะตอม E.N
Si 1.90
H 2.20
S 2.58
Br 2.96
Cl 3.16
สภาพมีขั้วของพันธะโควาเลนต์ต่อไปนี้ ข้อใดเรียงลำาดับจากมากไปน้อยได้ถกต้อง
ู
1. H-Cl, H-Br, Si-S, Si-H 2. H-Cl,
Si-S, Si-H, H-Br
3. H-Cl, H-Br, Si-H, Si-S 4. Si-H,
Si-S, H-Br, H-Cl
17.กำาหนดพลังงานพันธะเฉลี่ย
พันธะ พลังงา พันธะ พลังงาน
รพันธะ(kJ/mol) พันธะ(kJ/mol)
C-H 415 O=O 500
C-C 340 O-O 140
C=C 610 C-O 350
C≡C 840 O-H 460
C=O 740
ปฎิกิริยาในข้อใดคายพลังงานมากที่สุด
7
1. CH3-CH3+ O 2 → 2CO2+3H2O
2
2. CH2=CH2+3O2 → 2CO2+2 H2O
7. 5
3. CH ≡ CH+ O 2 → 2CO2+ H2O
2
4. CH3-CH-CH+3O2 → 2CO2+3H2O
18.ไอออนหรือโมเลกุลใดมีรูปร่างโมเลกุลเหมือนกัน และมีสภาพมีขั้วของโมเลกุลชนิดเดียวกัน
1. BeCl2(g) CO2 2. PCl5
ClF5
3. CCl4 XeF4 4. BCl3
PCl3
19.ถ้า O,P,Q และ R เป็นธาตี่มีเลขอะตอม 7,11,17 และ 20 ตามลำาดับ สูตรของสารประกอบ
ข้อใดเป็นไปได้
1. OQ 2. PO 3. Q2P3
4. R3O2
20.C5H10 เป็นสารประกอบไฮโดรคาร์บอนที่มีหลายไอโซเมอร์ ไอโซเมอร์เหล่านี้มีสตรโครงสร้างเป็นแบบ
ู
วงโซ่ตรง และโซ่กิ่ง ข้อใดเป็นจำานวนไอโซเมอร์ทถูกต้องทั้ง
ี่ 3 แบบ
แบบวง โซ่ตรง โซ่กิ่ง
1. 2 3 2
2. 3 2 3
3. 3 3 2
4. 4 2 3
21. สาร A ประกอบด้วยธาตุ 3 ชนิดคือ X.Y และ Z สาร A เป็นสารที่เสถียรและมีโครงสร้างดังนี้
ธาตุ X,Y,Z ควรเป็นธาตุดังข้อใด
X Y Z
1. N P Cl
2. O S Cl
3. P C F
4. N C H
22. สารประกอบในข้อใดที่ทกสารมีหมู่คาร์บอนีลอยู่ในโมเลกุล
ุ
ก. CH3COCH2COOCH3,CH3CH2CH2CHO , CH3CH2COCH2CH3
8. ข. CH3COCH2COOCH3, CH3OCH3, CH3CH2OCH2CH2OH
ค.
ง.
23.แก๊สผสมประกอบด้วย C2H6 , C 2 H4 และ C 2 H2 เมื่อเผาไหม้อย่างสมบูรณ์จะต้องใช้แก๊ส
O2 อย่างน้อยกี่
โมลและเกิด CO2 กี่ dm ที่ STP
3
ใช้ O2(mol) เกิด CO2(dm3)
1. 6 67.2
2. 9 134.4
3. 89.6
12 224.0
4.
15
ตัวเร่งปฏิกิริยา
24.โพรพานาไมด์ + H 2O สาร A + สาร B
ความร้อน
สาร B เปลียนสีกระดาษลิตมัสจากสีแดงเป็นสีนำ้าเงิน
่
พิจารณาข้อความต่อไปนี้
1. สาร B คือเอมีน
2. หมู่ฟังก์ชันของสาร A คือ -OH
3. สาร A ทำาปฏิกิริยากับโลหะโซเดียมเกิดแก๊สไฮโดรเจน
4. สาร A ทำาปฏิกิริยากับกรดเอทาโนอิกโดยมีกรดซัลฟิวริกเป็นตัวเร่งปฏิกิริยาได้โพรพิลเอทาโน
เอต
25.สาร A,B และ C เป็นสารประกอบไฮโดรคาร์บอน เมื่อนำาสาร A ทำาปฏิกิริยากับสารละลาย
โพแทสเซียมเปอร์แมงกาเนต และนำาสาร B และ C ทำาปฏิกิริยากับสารละลายโบรมีนในที่สว่างจะ
เกิดปฏิกิริยา ดังสมการ
A + KMnO4 + H 2O → C 3H 6O2
B + Br2 → C 3H 6Br
C + Br2 → C3H5Br + HBr
ข้อต่อไปนี้ข้อใดถูกต้อง
1. สาร A มีสตรโมเลกุล
ู C 3H4
ข. สาร B และ C เป็นไอโซเมอร์กัน
ค. สาร C ฟอกสีสารละลายโพเเทสเซียมเปอร์แมงกาเนต
9. ง. สาร A 1 mol เกิดปฏิกริยาการเผาไหม้อย่างสมบูรณ์ได้แก๊ส
ิ
คาร์บอนไดออกไซด์และนำ้าอย่างละ
3 โมล
1. ก และ ข เท่านั้น 2. ค และ ง เท่านั้น 3. ก, ค และ ง
4. ก ,ข และ ค
26.สาร X สามารถสลายตัวได้ดังสมการ
3X → 5Y + 6 Z
เมื่อวัดความเข้มข้นของสารละลาย x ในขณะที่เกิดปฏิกิริยาสลายตัวพบว่าได้ข้อมูลดังตาราง
ต่อไปนี้
เวลา (วินาที) (X) (mol / dm3)
0.00 1.00
5.00 0.850
10.00 0.750
15.00 0.700
20.00 0.670
ถ้าอัตราการเกิดปฏิกิริยาในช่วงเวลา 15 ถึง 20 วินาที มีค่าคงที่ และมีค่าเท่ากับอัตราการ
เกิดปฏิกิริยาเฉลี่ย
ในช่วงนี้ ความเข้มข้นของสาร X mol / dm3
ในหน่วย ทีเวลา
่ 17 วินาที มีค่าเท่าใด
1. 0.670 2. 0.688 3.
0.690 4. 0.700
27.เปรียบเทียบสารอินทรีย์แต่ละคู่ตอไปนี้
่ สารใดละลายนำ้าได้ดีว่ากัน
ก. กรดเอทาโนอิกกับบิวทานอล ข. กรดบิวทาโนอิกกับกรดโพรพาโนอิก
ค. บิวทานอลกับเพนทานอล ง. โพรพาโนนกับโพรพานาล
ก ข ค ง
1. กรดเอทาโนอิก กรดโพรพาโนอิก บิวทานอล โพรพาโนน
กรดโพรพาโรอิก เพนทานอล โพรพาโนน
2. กรดเอทาโนอิก กรดบิวทาโนอิก บิวทานอล โพรพานาล
3. บิวทานอล กรดบิวทาโนอิก เพนทานอล โพรพานาล
4. บิวทานอล
10. 28.พิจารณารูปต่อไปนี้
การเปรียบเทียบพลังงานก่อกัมมันต์ และการบอกชนิดของปฏิกิรยา
ิ I และปฏิกิริยา II ในข้อใดถูก
ต้อง
พลังงานก่อกัมมันต์ของปฏิกิริยา ปฎิกิริยาดูดความร้อน ปฎิกิริยาคายความร้อน
1. I = II I II
2. I > II I II
3. I < II II I
4. I II I
= II
29. ปฏิกิริยาต่อไปนี้เกิดในสถานะแก๊ส และอัตราการเกิดปฏิกิริยาขึ้นกับความเข้มข้นของทั้งสาร A,
และสาร B
A + B→ C
ก.- สาร A 1 mol ทำาปฏิกิริยากับสาร B 1 mol ในภาชนะขนาด 1 dm
3
ระบบ
ข. – สาร A 2 mol ทำาปฏิกิริยากับสาร B 2 mol ในภาชนะขนาด 2 dm
3
ระบบ
ระบบ ค. – สาร A 0.2 mol ทำาปฏิกิริยากับสาร B 0.2 mol ในภาชนะขนาด
0.1 dm3
จากข้อมูลข้างต้น จงหาว่า
Ι Ι. ระบบใดได้สาร C มากที่สุดภายในเวลาที่กำาหนด
ΙΙ. ระบบใดมีอตราการเกิดปฏิกิริยาสูงที่สูง
ั
Ι ΙΙ
1. ก ข
ข ค
2. ค ข
3. ค ค
4.
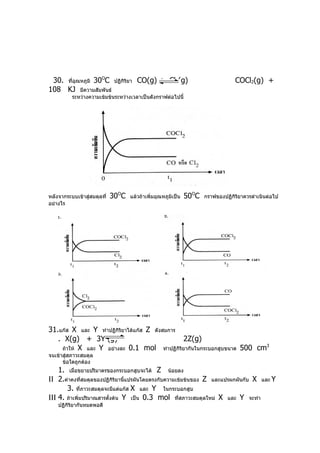
11. 30. ทีอุณหภูมิ 30OC
่ ปฏิกิริยา CO(g) + Cl2(g) COCl2(g) +
108 KJ มีความสัมพันธ์
ระหว่างความเข้มข้นระหว่างเวลาเป็นดังกราฟต่อไปนี้
หลังจากระบบเข้าสู่สมดุลที่ 30OC แล้วถ้าเพิ่มอุณหภูมิเป็น 50OC กราฟของปฏิกิรยาควรดำาเนินต่อไป
ิ
อย่างไร
31.แก๊ส X และ Y ทำาปฏิกิริยาได้แก๊ส Z ดังสมการ
. X(g) + 3Y (g) 2Z(g)
ถ้าให้ X และ Y อย่างละ 0.1 mol ทำาปฏิกิริยากันในกระบอกสูบขนาด 500 cm
3
จนเข้าสู่สภาวะสมดุล
ข้อใดถูกต้อง
1. เมือขยายปริมาตรของกระบอกสูบจะได้ Z น้อยลง
่
ΙΙ 2.ค่าคงทีสมดุลของปฏิกิริยานี้แปรผันโดยตรงกับความเข้มข้นของ Z และแปรผกผันกับ X และ Y
่
3. ที่ภาวะสมดุลจะมีแต่แก๊ส X และ Y ในกระบอกสูบ
ΙΙΙ 4. ถ้าเพิ่มปริมาณสารตั้งต้น Y เป็น 0.3 mol ทีสภาวะสมดุลใหม่ X และ Y จะทำา
่
ปฏิกิริยากันหมดพอดี
12. 32. ปฏิกิริยาข้อใดไม่ใช่ปฏิกิริยากรด - เบส
1.
2.
3. 2CH3COOH + 2Na → 2CH3COONa + H2
4. CH3COOH + NH3 → CH3COONH4
33. พิจารณาปฏิกิริยาสมมติตอไปนี้
่
A + B 2C
จากการทดลองได้ข้อมูลความเข้มข้นเริ่มต้นและความเข้มข้นที่สภาวะสมดุลของสารต่างๆใน
ปฏิกิริยานี้
การทดลองที่ ความเข้มข้นเริ่มต้น mol / dm3 ความเข้มข้นที่สภาวะสมดุล mol /
dm 3
[ A] [ B] [ C] [ A] [ B] [ C]
1. 0.04 0.04 0 0.02 M N
2. 0.03 0.02 0 X y z
ถ้าการทดลองที่ 1 และ 2 ที่ทำาอุณหภูมิ 30
o
C ค่า Z จะเป็นเท่าใด
1. 0.010 2. 0.012 3. 0.020
4. 0.024
34. นำ้าส้มสายชูตัวอย่างมีกรดอะซีตกอยู่รอยละ
ิ ้ 4.8/ โดยมวล ปริมาตร ในการไทเทรตนำ้าส้ม
สายชูกับสารละลายโซเดียมไฮดรอกไซด์พบว่านำ้าส้มสายชู 10 cm
3
ทำาปฏิกิริยาพอดีกับสารละลาย
NaOH 20 cm3 จงหาความเข้มข้นของสารละลาย NaOH ในหน่วยร้อยละโดยมวล /
ปริมาตร
1. 1.0 2. 1.6 3.
2.0 4. 2.4
35. สารละลายกรด HA ความเข้มข้น 1 × 10-3 mol / dm3 ปริมาตร 10 cm3 ร้อยละ
การแตกตัวของกรด
เท่ากับ 10 สารละลายนี้มี pH เท่าใด และมีค่า Ka โดยประมาณเท่าใด
pH K a (ประมาณ)
1. 3 1 × 10-3
2. 4 1.0 × 10-5
3. 5 1.0 × 10-4
4. 6 1.0 × 10-5
13. 36. จากข้อมูลอินดิเคเตอร์และช่วง pH ของการเปลี่ยนสี ดังตาราง
อินดิเค ช่วง pH สีที่เปลี่ยน
เตอร์
ก 3.2- 4.4 แดง – เหลือง
ข แดง – เหลือง
ค 4.2- 6.3 เหลือง – นำ้าเงิน
ง 6.0– 7.6 เหลือง – แดง
6.8 – 8.4
ข้อใดแสดงอินดิเคเตอร์ที่เหมาะสมสำาหรับการบอกจุดยุติของการไทเทรต
1. ไทเทรต NH4OH ด้วย HCI ใช้อินดิเคเตอร์ ค
2. ไทเทรต HNO3 ด้วย NaOH ใช้อินดิเคเตอร์ ง
3. ไทเทรต CH3COOH ด้วย NaOH ใช้อินดิเคเตอร์ ก
4. ไทเทรต NH4O H ด้วย HCN ใช้อินดิเคเตอร์ ข
37. สาร A และ B คูใดเมื่อผสมกันได้สารละลายบัฟเฟอร์
่
A สาร B สาร
1. CaCO3 หนัก 40 g HNO3 0.1 mol
2. NH4OH 1 mol / HCl 0.1 mol
dm3 100 cm3 NH4Cl 0.2 mol
3. CH3COOH 0.1 mol NaOH 1 mol /
4. H3PO4 1 mol / dm3 50 cm3
dm3 50 cm3
38. สาร A ประกอบด้วยฟอสฟอรัสและคลอรีน นำาสาร A 13.75 กรัม ไปทำาปฏิกิริยา
กับนำ้าจน ปฏิกิริยาสิ้นสุด ได้กรดฟอสฟอริก 9.8 กรัม และกรดไฮโดรครอริก
10.95 กรัม สาร A ประกอบด้วย คลอรีนร้อยละเท่าใดโดยมวล
1. 22.5 2. 25.8 3. 53.3
4. 77.5
39. เมื่อผสมสาร 2 ชนิดเข้าด้วยกันในขวดใบที่ 1 แล้วผ่านแก๊สที่เกิดขึ้นลงในสารละลาย Ca
(OH)2 ซึ่งอยู่
ในขวดใบที่ 2 จะทำาให้สารละลายขุ่น เมื่อนำาสารละลายผสมในขวดใบที่ 1 ไประเหยจน
แห้ง จะได้ของ
แข็งสีขาว สารผสมในข้อใดเป็นไปได้
ก.
HNO3 (aq) + CuCO3 (s) ข..
CH3COOH(aq) + NaHCO3(a)
ค.HCl (aq) + Na2 CO3 (aq) ง.
NH2 CONH2 (aq) + H2O(l)มียูรีเอสอยูด้วย
่
1. ก และ ข เท่านั้น 2. ข และ ค เท่านั้น 3. ก , ข และ ค เท่านั้น 4.
ก, ข , ค และ ง
14. 40.กำาหนดสูตรเคมีตอไปนี้ CaF2 . 3Ca3(PO4)2 ; Sb2S3 . 3H2O; Na2ZrSiO5
่
ถ้าเลขออกซิเดชันของ
Si = 4 พิจารณาเลขออกซิเดชันในข้อต่อไปนี้
ก. เลขออกซิเดชันของ P สูงกว่า +3 และของ Sb ตำ่ากว่า +5
ข. เลขออกซิเดชันของ Sb สูงกว่า +2 และของ Zr ตำ่ากว่า +1
ค. เลขออกซิเดชันของ Zr สูงกว่า +1 และของ P เท่ากับ +5
ง. เลขออกซิเดชันของ Zr เท่ากับ 0 และของ Sb สูงกว่า +3
ข้อใดผิด
1. ก และ ข 2. ก และ ค 3. ข และ ง 4. ค
และ ง
41. นักเรียนผู้หนึ่งละลายคลอไรด์ของธาตุ M ปริมาณ 0.05 mol ในนำ้ากลั่น แล้วปรับป
ปริมาตรให้เป็น
500 cm3 จากนั้นนำาสารละลายที่ได้ปริมาตร 12.5 cm3 ไปทำาปฏิกิริยาพอดีกับ
สารละลายซิลเวอร์ไน-
(AgNO3)
เตรด เข้มข้น 0.10 mol dm3 ได้ตะกอนซิลเวอร์คลอไรด์ สารประกอบ
คลอไรด์ขอองธาตุ M
มีสตรเป็นอย่างไร
ู
1.MCl 2. MCl2 3. MCl3
4. MCl4
Ις
ς กำาหนดค่าศักย์ไฟฟ้ามาตรฐาน
ปฏิกิริยาครึ่งเซลล์ Eo (V)
A2 + 2H+ + 2e- → H 2 A2 +0.68
3+
B + e -
→ B2+
+0.80
C2 + 2e- → 2C-
+1.07
D4 + e- → D3+ +1.45
ปฏิกิริยาใดต่อไปนี้เป็นปฏิกิริยาที่เกิดขึ้นได้เอง
ก. 2B3+ + H2 A2 2B2+ + A2 + 2H+
ข. A2 + 2H+ + 2C- H 2 A 2 + C2
ค. D4+ + B2+ D3+ + B3+
ง. 2B3+ 2C- 2B2+ + C2
15. 1. ก และ ข 2. ข และ ค 3. ค และ ง
4. ก และ ค
43. พิจารณาปฏิกิริยา Cr (OH)3 + ClO- CrO2-4 + Cl- +
H2O (สมการยังไม่ดล) จะต้อง
ุ
ใช้ NaOCl กีกรัมเพื่อทำาปฏิกิริยาพอดีกับ Cr (OH)3 1 mol
่
1. 74.5 2. 77.2 3. 111.8
4.223.5
44. พิจารณาสูตรโครงสร้างของผงซักฟอก 2 ชนิดต่อไปนี้
ข้อความใดผิด
1. ผงซักฟอกมีประสิทธิภาพซักล้างในนำ้ากระด้างดีกว่าสบู่ เพราะหมู่ ช่วยลด
ความกระด้างของนำ้า
2. ระบบเอนไซม์ขอองจุลินทรีย์สามารถย่อยสลายผงซักฟอกชนิด ข ได้อย่างดี จึงไม่กอให้เกิด
่
ปัญหาต่อสภาวะแวดล้อม
3. ระบบเอนไซม์ของจุลินทรีย์ไม่สามารถย่อยสลายผงซักฟอกชนิด ก ได้ จึงก่อให้เกิดปัญหาต่อ
สภาวะแวดล้อมอย่างมาก
4. สารฟอตเฟตในผงซักฟอกทีอยู่ในนำ้าทิ้ง เมือปะปนในแม่นำ้าลำาคลองทำาให้สาหร่ายและวัชพืชเจริญ
่ ่
งอกงามและแพร่พันธุ์อย่างรวดเร็ว จึงก่อให้เกิดปัญหาต่อสิ่งแวดล้อม
45. กำาหนดให้
X2+ (aq ) + 2e- X(S)
→ EO=+0.30 V
Y3+(aq)+3e- Y(S)
→ EO=+0.90
ถ้านำาครึ่งเซลล์X|Y (aq)มาต่อกับครึ่งเซลล์Y|Y3+ (aq)
3+
ที่ภาวะมาตรฐานข้อใดถูก
ต้อง
แคโทด แอโนด ตัวออกซิไดส์ ตัวรีดิวซ์
ςΙ 1. Ξ Y X X2+ Y
ςΙΙ 2. ΞΙ Y X Y3+ X
ςΙΙΙ3. ΞΙΙX Y Y3+ X
ΙΞ 4. X Y X2+ Y
46. ปัจจัยในข้อใดที่ทำาให้โปรตีนแปลงสภาพ
16. ก. การให้ความร้อน ข. ตัวทำาละลายอินทรีย์ ค. ไอออนของโลหะหนัก ง. การใช้กรด
และเบส
ข้อใดถูกต้อง
1. ก และ ข เท่านั้น 2. ค และ ง เท่านั้น 3. ก เท่านั้น 4. ก , ข , ค
และ ง
47. กำาหนดพอลิเมอร์ มีสูตรดังนี้
ข้อใดถูก
พอลิเเมอร์ ชนิด ปฏิกิริยาการเกิด
1. ก โฮโมพอลิเมอร์ การควบแน่น
ข โฮโมพอลิเมอร์ การควบแน่น
2. ค โคพอลิมอร์ การเติม
3. ง โคพอลิเมอร์ การควบ
4.
48. ข้อใดเป็นการเลือกปฏิบติได้เหมาะสมทีสุด
ั ่
1. เก็บขวดนำ้าพลาสติกไม่ใช่แล้วไว้ใส่นำ้ามันเบนซิน
2. ใช้ถ้วยชามที่ผลิตจากพอลิเอทิลีนอุ่นอาหารในเตาไมโครเวฟ
3. ใช้ภาชนะที่เคลือบด้วยพอลิเตตระฟลูออโรเอทิลีนในการทอดปลา
4. เก็บรวบรวมถ้วยชามประเภทเมลานีนที่ชำารุดไว้เพื่อการนำากลับไปใช้ใหม่
49.การถลุงแร่ในข้อใดที่มีหลักการในการถลุงเหมือนกัน
ก. สังกะสี ข. แคดเมียม ค. ดีบก
ุ ง. พลวง
1. ก และ ข 2. ข และ ค 3. ก , ข และ ง 4. ก , ค และ ง
50.ข้อใดต่อไปนี้ ไม่ถกต้อง
ู
1.มลพิษทางนำ้าที่เป็นสารจำาพวกฟอตเฟตได้มาจากการใช้ปุ๋ยเคมี ยากำาจัดวัชพืช และผงซักฟอก
ΞΙΙΙ2.สาร CFC และ DDT เป็นสารมลพิษที่มฮาโลเจน เป็นองค์ประกอบแต่สารไดออกซินเป็น
ี
สารมลพิษที่ไม่มีฮาโลเจน
ΞΙς3. แก๊สคาร์บอนไดออกไซด์ปริมาณมากเกิดจากการเผาไหม้เชื้อเพลิงเป็นสาเหตุหลักของการเกิด
ปรากฏ
การณ์เรือนกระจก
4.โอโซนเป็นแก๊สที่เป็นพิษเมื่ออยู่ในบรรยากาศระดับตำ่าแต่มีประโยชน์ในการป้องกันรังสี
อัลตราไวโอเลต
เมืออยู่ในบรรยากาศระดับสูง
่
17. ตอนที่ 2 ข้อ 1–8 เป็นข้อสอบอัตนัย
1. X และ Y เป็นธาตุ 2 ชนิด หนึ่งโมเลกุลของ X มี 4 อะตอม และมีมวลโมเลกุล 124
หนึ่งโมเลกุลของ
Y มี 2 อะตอม และมีมวลโมเลกุล 32 XY43- 1.505 × 1023 ไอออนคิดเป็นนำ้าหนักกี่
กรัม
2. ในการสังเคราะห์แสงขอสาหร่ายสีเขียวพบว่าใช้ CO2 6 × 10-3 mol / hour ถ้าการ
สังเคราะห์แสงให้
ผลิตภัณฑ์เป็นแป้ง ( C6 H10 O5 ) เท่านั้น จะต้องใช้เวลากี่ชั่วโมงในการสังเคราะห์แสง
เพื่อให้ได้แป้ง
หนัก 1.62 กรัม
3. สารประกอบชนิดหนึ่งประกอบด้วย C , H และ O มี C ร้อยละ 39.13 และ O ร้อยละ
52.17 สาร
ประกอบนี้มีสตรเอมิรคัลและสูตรโมเลกุลเหมือนกัน เมือนำาสารประกออบนี้หนัก
ู ิ ่ 6.90 g
ละลายใน
เอทานอลจำานวนหนึ่งหาจุดเดือดของสารละลายได้ 80.90oC ถ้าจุดเดือดของเอทานอลเท่ากับ
78.50 C o
และค่า Kb ของเอทานอลเท่ากับ 1.22oC mol-1kg-1 จงหานำ้าหนักเป็นกรัมของเอานอล
ในสารละลาย
4.สารอินทรียชนิดหนึ่งมีธาตุ N เป็นองค์ประกอบ เมือสลายสารอินทรีย์นี้ 1.5 g แล้วผ่านแก๊ส
์ ่
NH3 ทีได้ลงในสารละลาย HCl เข้มข้น 0.10 mol dm-3 ปริมาตร 50 cm3 นำาสารละลาที่
่
ได้มาไทเทรตด้วยสารละลายมาตรฐาน NaOH เข้มข้น 0.1 mol dm
-3
ปรากฏว่าใช้ไป 30
cm จงหาร้อยละโดยมวลของไนโตรเจนในสารละลาย
3
5.ถ้าต้องการเตรียมสารละลาย CuSO4 เข้มข้น 0.1 mol dm-3 ปริมาตร 500 cm3 จาก
CuSO4 . 5H2O ซึ่งมีความบริสุทธิ์ร้อยละ 99.8 จะต้องใช้ CuSO4 . 5H2O หนักกีกรัม
่
6.นำ้ามันชนิดหนึ่งประกอบด้วยกรดไขมันร้อยละ 21.4 โดยมวล โดยเป็นกรดไขมัน 3 ชนิดคือ A,B
และ C ซึ่งมีอตราส่วนจำานวนโมลเป็น 2 : 1 : 1 ตามลำาดับ
ั
กรด สูตรทั่วไป มวลโมเลกุล
A C15 H29 254
B COOH 280
C C17 H31 COOH 282
C17 H33
COOH
18. ถ้าพันธะคู่ 1 พันธะ ทำาปฏิกิริยากับ 2 1 โมเลกุล นำ้ามัน 100 g จะทำา
ปฏิกิริยาพอดีกับ 2 กีกรัม
่
7. นำาแร่พลวงเงินที่มี Sb2S3 34% หนัก 200 กรัม มาเผาให้ร้อนจัด ( อย่างแรง ) จน
กำามะถันในแร่พลวง
เงินเปลี่ยนเป็น SO2 จนหมด จงคำานวณหาปริมาตรของ SO2 ที่เกิดขึ้นเป็นลูกบาศก์เดซิเมตร ที่
STP
8. นักเรียนคนหนึ่งทำาการทดลองหาร้อยละโดยมวลของแป้งในยาลดกรด ซึ่งมีส่วนผสมของ MgCO3
และแป้งดังนี้
1. ชังยาลดกรด
่ 1.00 g บดให้ละเอียดละลายในนำ้ากลั่น 20 cm3
Ξς เติมสารละลาย HCI เข้มข้น 1.00 mol dm -3
ปริมาตร 20 cm3 ลงในสารละลายในข้อ
1 นำาไปอุ่น
3. กรอง ล้างภาชนะด้วยนำ้ากลั่นปริมาณเล็กน้อย แล้วเทชะบนกระดาษกรอง 2- 3 ครั้ง
4. ทำาสิ่งทีกรองได้ให้มีปริมาตร 100 cm 3
่ ในขวดวัดปดริมาตร
5. ปิเปตสารละลายในข้อ 4 มา 10cm 3 ไทเทรตด้วยสารละลาย NaOH เข้มข้น
0.20 mol dm-3 ที่
จุดยุติใช้สารละลาย NaOH 5.0 cm
3
จงคำานวณหาร้อยละโดยมวลของแป้งในยาลดกรด
19. ตอนที่ 1
1. เฉลยข้อ 3
แนวคิด ถูก เพราะปัจจัยที่มีผลต่อ ความดันไอของของเหลว คือ
1. แรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลวความดันไอของของเหลวเป็นสัด
ส่วนกลับแรงยึดเหนี่ยวระหว่างโมเลกุลของของเหลว
2. อุณหภูมิ ความดันไอของของเหลว เป็นสัดส่วนตรงกับอุณหภูมิ
2 เฉลยข้อ 2
แนวคิด ให้สาร A, B และ C ต่างใช้จำานวน 1 mol ละลายนำ้าที่ปริมาตร 100
cm3
สารในนำ้า ความร้อนของการ เหตุผล
ละลาย
A ดูดพลังงาน พลังงานไฮเดรชัน น้อยกว่าพลังงานแลตทิช =
ดูดพลังงาน
B ดูดพลังงาน 750-745 = 5
C พลังงานไฮเดรชัน มากกว่าพลังงานแลตทิช =
590-550 = 40
พลังงานไฮเดรชัน น้อยกว่าพลังงานแลตทิช 700 -
690 = 10
การเปรียบเทียบอุณหภูมิของแต่ละสารละลาย B > A > C
3. เฉลยข้อ 2
M
แนวคิด สมมติให้ความหนาแน่นของตัวทำาละลาย X = x g/cm3 สูตร d
V
M = dV
X 100 cm3
ตัวทำาละลาย มีมวล = 100 X g. และตัวทำาละลาย X 50
cm3
มีมวล = 50X g.
20. 0.2
สารละลาย Y ใน X มีความเข้มข้น = (100X ) =
Kg
1000
2
mol / kg
X
สูตร ∆Tf = K f × m
2
แทนค่า (5.5 – (-4.3) ) = K f ×
X
สารละลาย Z ใน X
m1 × 1000
สูตร ∆Tf = Kf ×
m 2 × M.W 1
8.4 × 1000
แทนค่า (5.5 – (-4.3 ) ) = K f × ( 50X× M.W
) 1
2 8.4 × 1000
แต่ Kf × = K f × ( 50X× M.W
)
X 1
1000
Z = 8.4 × 50M.W จะได้
1
M. W 1 = 84
หาสูตรเอมพิริคล
ั
85.71 14.29
C:H = : โดยมวล
12 1
7.14 14.29
C:H = : โดยโมล
7.14 7.14
C:H = 1.00 : 2.00 โดยโมล
สูตรเอมพิรคัลของ Z
ิ คือ C1 H2
ให้สตรโมเลกุล ( CH2 )n
ู
มวลโมเลกุลของ Z = 84
(12+2 ) = 84
∴n = 6
สูตรโมเลกุล ( CH2 )6 จะได้ C6 H12
4. เฉลยข้อ 4
แนวคิด จากข้อมูลการทดลอง สรุปได้ว่า
1. ทีจุด Y สารตัวอย่าง
่ (A+B) แยกได้ 1 แถบ ซึ่งเคลื่อนที่ได้ระยะ
ทางเท่ากับ
สาร A บริสทธิ์ จากจุด
ุ X ดังนั้น สาร B อาจเป็นสารไม่มีสี
จึงควรตรวจสมบัตต่อ
ิ
ไปนี้ด้วยการผ่านแสงอัลตราไวโอเลต
2. สาร A และสาร B เคลื่อนที่ไปบนตัวดูดซับได้ใกล้
เคียงกันมาก จึงเห็นเป็น
แถบเดียว จึงควรทำาการทดลองซำ้าโดยเปลี่ยนตัวทำาละลาย
5. เฉลย ไม่มีคำาตอบ
21. แนวคิด เขียนสมการแสดงปฏิกริยาพร้อมดุล
ิ
แร่ตัวอย่าง 1.12 g KI ( aq ) 1 mol . dm-3
10 cm3
↓ ↓
2Fe (aq)
3+
2I –(aq)
→ 2Fe 2 + (aq) + I 2 (aq)
↓ ↓
↓
1 × 10
X g mol
1000
44.8 cm3
↓
↓
X
mol
56
44.8
mol
22.4 × 1000
จากขัอมูลที่โจทย์ให้มากำาหนดทั้งจำานวนโมลของสารตั้งต้น KI
และจำานวนโมลของ
ผลิตภัณฑ์ I 2 ในการคำานวณจะต้องยึดเอาจำานวนโมลของผลิตภัณฑ์
I 2 เป็นหลัก
กล่าวคือ KI จำาถูกใช้ทำาปฏิกิริยาหมดหรือไม่กตาม I 2 ต้องเกิดขึ้น
็
กับจำานวน 44.8
cm3 STP อย่างแน่นอน จึงใช้สารนี้เป็นหลักในการคำานวณ ดังนี้
3+
โมล
Fe 2
จากสมการ =
โมลI2 I
X
mol
56 2
=
44.8 I
mol
22.4 × 1000
2 × 44.8 × 56
∴X = = 0.224g
22.4 × 1000
3+
แร่ตัวอย่าง 1.12 g มีเหล็กในรูป Fe = 0.224g
แร่ตัวอย่าง 100 g มีเหล็กในรูป
0.224 × 100
Fe 3 + = = 20g
1.12
แร่ตัวอย่างมีเหล็ก
= 20% โดยมวล
6.เฉลยข้อ 4
แนวคิด สมการของปฏิกิริยา ดังนี้
22. A + 3B 4C
ผลได้ของสาร c ที่คำานวณได้จากสมการของปฏิกิริยาเป็นผลได้ตามทษฏีของ
สาร C=X mol
ผลได้จริง
ร้อยละของผลได้ = x 100
ผลได้ตามทษ ฏี
6
75 = x100
X
6 × 100
∴X = = 8 mol
75
โมลA 1 โมลA 1
จากสมการ = แทนค่า = จะได้สาร
โมลC 4 8 4
A = 2mol
โมลB 1 โมลB 4
= แทนค่า =
โมลC 4 8 3
จะได้สาร B = 6mol
7. เฉลยข้อ 2
2.3
แนวคิด ข้อ 1 ผิด NO2 มี = 0.05mol เป็นสารประกอบโคเวเลน
46
ต์
NO2 1 mol = มีจำานวน =
6.02 × 10 23 โมเลกุล
NO2 0.05 mol = มีจำานวน
23
6.02 × 10 × 0.05
=
1
= 0.301 × 10 23 โมเลกุล
1.18
ข้อ 2 ถูก N (CH 3 ) 3 มี = 59 = 0.02mol เป็น
สารประกอบโคเวเลน
N (CH 3 ) 3 1 mol มีจำานวน
= 6.02 × 10 23 โมเลกุล
N(CH 3 ) 1 mol มีจำานวน
23
6.02 × 10 × 0.02
=
1
= 1.204 × 10 23 โมเลกุล
5.85
ข้อ 3 ผิด NaCl มี = 0.1mol เป็น
58.5
สารประกอบไอออนิก
23. NaCl มีจำานวน = 6.02 × 10 23
โมเลกุล
NaCl 0.1 mol มีจำานวน
6.02 × 10 23 × 0.1
=
1
= 6.02 × 10 22 โมเลกุล
ข้อ 4 ผิด H 2SO 4 เป็นสารประกอบโคเวเลนต์ไม่ใช่
สารประกอบไอออนิก
8. เฉลยข้อ 2
แนวคิด โลหะ A ถูกยิงด้วยอนุภาคแอลฟาเกิดอิเล็กตรอนกระเด็นออกไปเกิด A3+
ไอออน
ร้อยละ 0.10 ดังสมการ
A → A 3 + (g) + 3e −
โลหะ A 100 mol A ทีถกอนุภาคแอลฟาเกิด
่ ู
อิเล็กตรอนกระเด็นออกไป
=
0.1 mol
โลหะ A 2 mol A ทีถกอนุภาคแอลฟาเกิด
่ ู
อิเล็กตรอนกระเด็นออกไป
=
0.1 × 2
= 2 × 10 − 3 mol
100
จากสมการโลหะ A 1 mol เกิด A3+ และ
อิเล็กตรอนทีกระเด็นออกไป
่
=
3 × 6.02 × 10 23 อนุภาค
A 2 × 10 −3 mol เกิด A
3+
โลหะ และ
อิเล็กตรอนทีกระเด็นออกไป
่
=
3 × 6.02 × 10 23 × 2 × 10 −3
อนุภาค
1
= 3.6 × 10 21 อนุภาค
9. เฉลยข้อ 1
24. แนวคิด ธาตุ พลังงานไอออไนเซชัน IE 1 − IE 9 (MJ / mol ดังนี้
1.73.46.18.411.015.9
.217 92.1106.4
X
n =2
n =1
พลังงานเฉลี่ย พลังงานเฉลี่ย
1 . 7 + 3 . 4 + 6 . 1 + 8 . 4 + 11 . 0 + 15 . 2 + 17 . 9
= =
7
92.1 + 106.4
2
63 . 7
= = 9.1 MJ
7
= 99.25 MJ
Y 0.5 n = 3 พลังงานเฉลี่ย
= 0.5 MJ
4.6. 6.9 9.6 13.4 16.6 20.1 25.5 28.9 n =2
พลังงานเฉลี่ย = 15.7 MJ
141.4 159.1 n =1 พลังงานเฉลี่ย
= 150.25 MJ
ข้อ 1 ผิด เพราะอิเล็กตรอนใน n=1 ของ X ต้องคายพลังงาน 99.25
MJ / mol เพื่อไปอยู่
ใน n=2
2 ถูก เพราะผลต่างของพลังงานของ n = 1
ข้อ กับ n=2 ใน Y=
(150.25 – 15.7 =
134.55 MJ
มีค่ามากกว่า ผลต่างของพลังงานของ n=1 กับ n=
2 ใน X = ( 99.25 – 9.1 ) =
90.15 MJ
ข้อ 3 ถูก เพราะจากการจัดกลุ่มอิเล็กตรอนในระดับพลังงานต่าง ๆ พบว่าธาตุ X
มีระดับพลัง
งาน 2 ระดับ n = 1 มี 2 อิเล็กตรอน n = 2 ซึ่ง
เป็นเวเลนต์อิเล็กตรอน มี 7
อิเล็กตรอน แสดงว่าธาตุ X อยู่หมู่ 7 แต่ 53 Ι มีเลขอะตอม
= 53 มีจำานวนโปร –
ตรอน = จำานวนอิเล็กตรอน = 53 มีการจัดอิเล็กตรอนใน
ระดับพลังงานต่าง ๆ ดังนี้
2 , 8 ,18 , 18 , 7 มีเวเลนต์อิเล็กตรอน 7 อยู่หมู่ 7 เช่น
เดียวกับ ธาตุ
ข้อ 4 ถูก เพราะ X มีเวเลนต์ตรอน =7 เป็นธาตุอโลหะ เกิดไอออนลบคือ X
-
Y มีเวเลนต์ตรอน =1 เป็นธาตุโลหะ เกิด
ไอออนบวกคือ Y +
25. สารประกอบของ Y( โลหะ ) กับ X ( อโลหะ ) เป็นสารประกก
อบไอออนิก มีสูตร YX
10 . เฉลยข้อ 4
แนวคิด ธาตุนี้มีจำานวนโปรตรอน (P ) = จำานวนอิเล็กตรอน (e- )= 7 การจัด
อิเล็กตรอนในระดับพลัง
งานต่าง ๆ เป็น 2,5 n = 1 มีจำานวนอิเล็กตรอน n = 2 มี
จำานวน 5 อิเล็กตรอน จากแผน
ภาพไม่มีข้อใดถูก จึงเลือกข้อ 4
11. เฉลยข้อ 1
แนวคิด จากข้อมูล
Ι ธาตุ Χ มีค่า ΙΕ 2 และ ΙΕ 3 ต่างกันมาก ๆ แสดงว่า
อิเล็กตรอนทั้ง 2 อยูต่าง
่
ระดับพลังงานกัน ดังนั้นเวเลนต์อิเล็กตรอนของ Χ =2 เกิดไอออน
ที่มีประจุ +2
AI
ΙΙ 13 ,มีการจัดอิเล็กตรอนในระดับพลังงาน 2, 8 , 3 หมู่ 3 อยู่
หมู่เดียวกับ Y และ Y
อยู่หมู่ 3
ΙΙΙ ไอโซโทปหนึ่งของ Z ไม่มีนิวตรอน คือ ธาตุไนโตรเจนเป็นอโลหะ
ซันไฟรด์ของ X ซันไฟรด์ของ Y ซันไฟรด์
ของ Z
X S Y S
Z S
2 3
2
+2 -2 3 2
1 2
1 2
12. เฉลยข้อ 4
แนวคิด ธาตุอโลหะหมู่เดียวกัน ธาตุ อโลหะอิสระทีอยู่บนกว่าในตารางธาตุสามารถทำาปฏิกิริยา
่
กับ
ไอออนลบของอโลหะตัวล่างกว่าในหมู่เดียวกันได้
จากข้อมูลนำามาวิเคราะห์ได้ดังนี้
26. Ι ΚΧ ไม่ทำาปฏิกิริยากับ Υ2 : 2X− + Υ2
X2 + 2Y−
แสดงว่า Υ2 รับอิเล็กตรอนของ Χ − ไม่ได้ นั่นคือธาตุ Χ อยู่บนธาตุ
Υ อยูล่าง
่
ΙΙ ΚΖ ทำาปฏิกิริยากับ Υ2 : 2Ζ − + Υ2
Ζ 2 + 2Υ −
แสดงว่า Υ2 รับอิเล็กตรอนของ Ζ − ได้ นั่นคือธาตุ Υ อยู่บน ธาตุ Ζ อยู่
ล่าง
จาก Ι และ ΙΙ สรุป ธาตุในหมู่เดียวกัน เรียงจากเลขอะตอมน้อยไปมาก (
หรือบนลงล่าง )
ดังนี้ ( บน ) Χ, Υ , Ζ ( ล่าง )
X 2Y2Z2
มาก → น้อย ความสามารถในการรับอิเล็กตรอน และความแรงใน
การรับออกซิ
ไดส์
X-Y− Z−
ยาก → ง่าย ความสามารถในการให้อิเล็กตรอน และความแรงในการ
รีดิวซ์
ข้อ 1 ผิด เพราะ Z- เป็นตัวรีดิวซ์ทดีกว่า
ี่ X- และ Y-
ข้อ 2 ผิด เพราะผสม KY กับ X2 เกิดปฏิกริยาเคมี
ิ เนื่องจาก X2 รับ
อิเล็กตรอนของ Y –
ได้
ข้อ 3 ผิด เพราะเวเลนซ์อิเล็กตรอนของ X- หลุดอยากกว่าเวเลนซ์
อิเล็กตรอนของ Y –
และของ Z -
ข้อ 4 ถูก เพราะผสม KZ กับ X2 เกิดปฏิกิริยาดังนี้ 2KZ + X2
2KX + Z2 เนื่อง
จาก X2 รับอิเล็กตรอนจาก Z- ได้
13.เฉลยข้อ 3
238 สลายอนุภาคต่าง ๆ ทั้งหมด 14 ขั้นตอนเป็นรังสี α 8 ขั้นตอน และรังสี β
แนวคิด 92U
4
6 ขั้นตอน แต่รังสี α เขียนเป็นสูตร 2H 8 ขั้นตอน จะพบว่าเลขมวลลด 4 x 8
= 32
β 0
และเลขอะตอมลดลง 2 x 8 = 16 และรังสี สูตรเป็น −1e 6 ขั้น
ตอน เลขมวลไม่ เปลี่ยนแปลง เลขอะตอมเปลียน
่ = -1 x 6 = -6 ดังนั้น
ผลิตภัณฑ์มีเลขมวล เป็น 238 – 32 = 206
206
เลขอะตอม 92 – 16 ( -6 )= 82 จากตัวเลือกคือ 382 Pb
.14. เฉลยข้อ 4
แนวคิด
27. ตัวเลือกที่ 4 ถูกเรียงจำานวนอิเล็กตรอนคู่โดดเดี่ยวของอตอมกลางต่อไปนี้
CIF 3 > NCI3 > CIO4
15. เฉลยข้อ 2
แนวคิด ข้อ 1 ผิด เพราะสารประกอบที่เกิดจากธาตุหมู่ I กับ VI อัตราส่วนโดยมวลอะตอม
2 : 1 เป็นสารประกอบไอออนิก จุดเดือดสูงละลายนำ้า แสดงสมบัติเป็นเบส เช่น Na2O
ข้อ 2 ถูก เพราะสารประกอบที่เกิดจากธาตุหมู่ V และ VI อัตราส่วน
โดยอะตอม
2 : 3 เป็นสารประกอบโคเวเลนซ์ จุดเดือดตำ่าละลายนำ้าแสดงสมบัติเป็นกรดได้ เช่น
N2O3
ข้อ 3 ผิด เพราะสารประกอบที่เกิดจากธาตุหมู่ II และหมู่ V II
อัตราส่วนโดยมวล
อะตอม 1 : 2 เป็นสารประกอบไอออนิก ( ยกเว้น BeCI 2 เป็นสารประกอบโคเวเลนซ์
) จุดเดือดสูง
ข้อ 4 ผิด เพราะสารประกอบที่เกิดจากหมู่ II และ V II อัตราส่วยโดย
มวลอะตอม
1 : 2 เป็นสารประกอบไอออนิก จุดเดือดสูงไม่ละลายนำ้า CaC2
16. เฉลยข้อ 1
แนวคิด
สภาพมีขั้วของพันธะโคเวเลนต์ เปลี่ยนตามผลต่างของ
EN สภาพมีขั้วของพันธะโคเวเลนต์ เรียงจากมากไปน้อย ดังนี้
พันธะ H - CI > H - Br > Si - S > Si
- H
∆EN∆ ( 3.16 - 2.20 ) ( 2.96 - 1.90 ) ( 2.58 -
1.90 ) ( 2.2 - 1.90 )
= 0.96 = 0.76 =
0.68 = 0.3
17. เฉลยข้อ 1
7
แนวคิด ข้อ 1 CH3 - CH3 + O2 2CO2 + 3H2O
2
7
∑Ε = 6DC-H + 1DC-C + DO O = ( 6 x 415 ) +
=
ดูด
2
( 1 x 340 )
+
7×500
= 4580 kJ.
2
28. = 4DC=O + 6D
∑Ε คาย H-O = ( 4 x 740 ) + ( 6 x
460 ) = 5720 kJ.
= 5720 - 4580 = 1140 kJ .
คายพลังงาน
ข้อ 2 CH2 = CH2 + 3O2 2CO2 +2H2O
∑ Ε ดูด = 4DC-H + 1DC-C + 3DO+O = ( 4 x415 ) +
( 610 ) + ( 3 x 500 )= 3770 kJ.
∑ Ε คาย = 4DC=O + 4DO-H = ( 4 x 740 ) + ( 4 x 470
) = 4800 kJ.
คายพลังงาน = 4800 –3770 = 1030 kJ.
5
ข้อ 3 CH ≡ CH + O2 2CO2 + H2O
2
5
∑ Ε = 2DC-H + D C≡C+ D O O= ( 2 x 415 ) + ( 840 )
=
ดูด
2
5
+ ( × 500 =2920 kJ.
)
2
∑ Ε = 4DC=O + 2DH-O = ( 4 x740 ) + ( 2 x 460 ) =
คาย
3880 kJ.
คายพลังงาน = 3880 –2920 = 960 kJ.
ข้อ 4 CH3 - CH3 - OH + 3O2 2CO2 + 3H2O
∑ Ε ดูด = 5DC – H + 1DC-C + 1DC – O + 1DO – H +3DO =O
=
OO = ( 5 x 415 ) + ( 1 x 340 ) + (
1 x 350 ) + ( 1 x 460 ) + ( 3 x 500 )
= 4725 kJ.
∑ Ε คาย = 4DC=O + 6D H-O = ( 4 x 740 ) + ( 6 x 460 ) =
5720 kJ .
ปฏิกิริยาที่คายพลังงานมากที่สุด คือ ปฏิกิริยาข้อที่ 1
18. เฉลยข้อ 1
แนวคิด เพราะ BeCI2 (g) และ CO2 ต่างมีรูปร่างโมเลกุลเหมือนกันคือ เป็นเส้นตรง
และต่างก็เป็น
โมเลกุลไม่มีขั้วเหมือนกัน
19. เฉลยข้อ 4
แนวคิด
29. ธาตุ เลขอะตอม การจัดอิเล็กตรอนในระดับพลังงาน
O 7 2 ,5
P 11 2,8,1
Q 17 2,8,7
R 20 2,8,8,2
ข้อ 1 ผิด เพราะ O Q เป็น OQ3
e- คู่ร่วมพันธะ 3 1
2
+ 3− P3O
ข้อ ผิด เพราะ P O เป็น
ประจุ 1 3
− +
ข้อ 3 ผิด เพราะ Q P
ประจุ 1 1
ข้อ 4 ถูก เพราะ 2+ 3− เป็น R 3 O2
R O
ประจุ 2 3
20. เฉลย ไม่มีคำาตอบถูก
แนวคิด C5H10 เป็นสูตรโมเลกุลของแอลคีน หรือไซโคลแอลคีน
2 ไอโซเมอร์โซ่ตรง
CH2 = CH - CH2 - CH2 – CH3 CH3 –
CH = CH - CH2 – CH3
โซ่กิ่ง 3 ไอโซเมอร์
CH2 = C - CH2 – CH3 CH2 = CH - CH - CH3
CH3 - CH = C - CH3
CH3 CH3
CH3
แบบวง 5 ไอโซเมอร์
30. 21. เฉลยข้อ 1
แนวคิด สาร A เป็นสารที่เสถียรมีโครงสร้าง ดังนี้
ธาตุ X,Y และ Z แทนด้วยธาตุ N,P,Cl ตามลำาดับ
22.เฉลยข้อ 1
แนวคิด ข้อ ก,ค และ ง ทุกสารมีหมู่คาร์บอนีล มีสูตร
23. เฉลยข้อ ไม่มีคำาตอบที่ถก
ู
แนวคิด ข้อสอบข้อนี้โจทย์กำาหนดข้อมูลมาให้ไม่พอที่จะไปคำานวณหาจำานวนโมลของ
แก๊ส O2
และปริมาตรของแก๊ส CO2 เป็น dm3STP ได้
ถ้าจะคำานวณต้องกำาหนดจำานวนโมลของ C 2H6,C 2H4
และ C2H2 ของแก๊สแต่ละ
ชนิดที่ผสมกันมาให้ เช่น กำาหนด C2 H6,C 2H4 และ C
2 H2 อย่างละ 1 mol
ทำาปฏิกิริยาเผาไหม้อย่างสมบูรณ์ดังสมการ
31. 7
1C 2H6 + O2
2
2CO2 + 3H 2O (g)
1C 2H4 + 3O2
2CO2 + 2H 2O (g)
1C 2H2
2CO2 + H 2O (g)
7 5
ใช้ O2 รวม = + 3+ mol เกิด CO2 รวม = 2
2 2
+ 2 + 2 = 6 mol
18
= = 9 mol
2
= 6 x 22.4 = 134.4 dm3STP
ถ้าเป็นเช่นนั้นก็ต้องตอบตัวเลือกข้อ 2 ถูก แต่เนื่องจากโจทย์
กำาหนดข้อมูลมาให้ไม่ครบ
จึงไม่มีคำาตอบที่ถก
ู
24. เฉลยข้อ 4
แนวคิด โพรพานาไมด์เป็นเอไมด์ สูตร
ข้อ ก ผิด เพราะสาร B เป็นแก๊สแอมโมเนีย
ข้อ ข ผิด เพราะสาร A มีหมูฟังก์ชัน คือ
่
ข้อ ค ถูก เพราะสาร A เป็นกรดอินทรีย์ทำาปฏิกิริยา
กับ Na เกิด H2 ดังนี้
ข้อ ง ผิด เพราะสาร A ไม่ทำาปฏิกิริยากับกรดเอทาโนอิกด้วย
กรดซัลฟิวริกเป็นตัว
เร่งปฏิกิริยาเนื่องจากเป็นกรดอินทรีย์เหมือนกัน
25. เฉลยข้อ 4
แนวคิด สมการของปฏิกริยายังไม่ดุล
ิ
32. ข้อ ก ถูก เพราะสาร A มีสูตรโมเลกุล C 3H4 คือ ไซโคลโพรพีน
ข้อ ข ถูก เพราะสาร B และ C เป็นไอโซเมอร์กัน มีสูตรเหมือนกัน คือ C
3 H6 โดยสาร B คือ
CH2 = CH – CH3 สาร C คือ
ข้อ ค ผิด เพราะสาร C เป็นไอโซโคลแอลเคน ไม่ฟอกจางสีด่างทับทิม (
โพแทสเซียมเปอร์แมงกา
เนต ) ในกรดได้
ข้อ ง ถูก เพราะสาร A เกิดการเผาไหม้อย่างสมบูรณ์ได้ดังสมการ
9
1C 3H6 + O2 3CO2 + 3H
2
2O (g)
26. เฉลยข้อ 2
แนวคิด จากตารางข้อมูล อัตราการเกิดปฏิกิริยาในช่วงเวลา 15 ถึง 20 วินาที มีค่าคงที่
1 0 . 700 − 0 . 670
= 3 × 20 − 15
mol /
dm3 – S
1 0 . 03
= × mol / dm3-S
3 5
แต่อัตราการเกิดปฏิกิริยาที่ช่วง 15 ถึง 20 วินาที = อัตราการเกิด
ปฏิกิริยาเฉลี่ยในช่วงเวลานี้
มีค่าคงที่ เมื่อตัดบางส่วนข้อมูลมาดังนี้
เวลา(S) (X) ( mol/
33. dm3)
15.00 0.700
17.00 X
20.00 0.670
ดังนั้นอัตราการเกิดปฏิกิริยาในช่วง 15 ถึง 17 =
0 . 700 − X
1
17 − 15
3
1 0 . 03
× =
3 5
1 0.7 − X
×
3 2
∴X
0 . 03 × 2
= 0.7 - = 0.688 mol/dm3
5
ความเข้มข้นของสาร X ที่ 17 S = 0.688 mol/dm3
27. เฉลยข้อ 1
แนวคิด
ส่วนมีขั้ว ในแอลกอฮอล์ และ กรดอินทรีย์ ละลายนำ้าซึ่งเป็นโมเลกุลมีขั้วได้ดี ถ้าหมู่ R- มี C
อะตอม
น้อย และถ้า C อะตอมมากขึ้นจะละลายนำ้าลดลงจน C อะตอมใน R- เพิ่มถึงขีดหนึ่งจะไม่ละลาย
นำ้า
สรุป การละลายนำ้าของแอลกอฮอล์ และกรดอินทรีย์
1. แอลกอฮอล์ และกรดอินทรียที่ มี
์ C อะตอมน้อยละลายน้ได้ดี กว่าคือ แอลกอฮอร์
C1 - C3
ละลายนำ้าไม่จำากัด กรดอินทรีย์ C1 - C4 ละลายนำ้าได้ไม่จำากัด C อะตอมมากขึ้นจะละลายนำ้าลดลง
จนไม่ละลายนำ้า
2. กรดอินทรีย์และแอลกอฮอล์ที่มี C อะตอมเท่ากันกรดอินทรีย์ละลายนำ้าได้มากกว่าเพราะ
กรดอินทรีย์เกิดพันธะไฮโดรเจนได้ทากแห่งกว่า
ข้อ ก กรดเอทาโนอิก ( CH3COOH ) ละลายนำ้าได้ดีกว่าบิวทานอล ( CH3(
CH2 ) 3 OH ) เพราะ
C อะตอมน้อยกว่าและเกิดพันธะไฮโดรเจนได้มากกว่า
ข้อ ข กรดโพรพาโนอิก (CH3CH2 COOH ) ละลายนำ้าได้ดกว่ากรดบิวทาโนอิก
ี ( CH3(
CH2 ) 2COOH )
34. เพราะมีจำานวน C อะตอมน้อยกว่า
ข้อ ค บิวทานอล ( CH3( CH2 ) 3 OH ) ละลายนำ้าได้ดีกว่าเพนทานอล ( CH3(
CH2 ) 4 OH ) เพราะ
มี C อะตอมน้อยกว่า
ข้อ ง โพรพาโนน ( CH3COCH3 ) ละลายนำ้าได้ดกว่า
ี ( CH3COOH ) โพรพา
นอล (CH3 CH2 CHO)
เพราะมีสภาพขั้วแรงกว่า
28.เฉลยข้อ 2
แนวคิด
จากกราฟ การเปรียบเทียบพลังงานสารตั้งต้น พลังงานก่อกัม
ของปฏิกิริยา และพลังงานผลิต ปฏิกิริยาแบบ มันต์ของ
ปฏิกิริยา
Ι พลังงานสารตั้งต้น ตำ่ากว่าพลังงาน
ผลิตภัณฑ์
ดูดความร้อน }I≥ II
ΙΙ พลังงานสารตั้งต้น สูงกว่าพลังงาน คายความร้อน
ผลิตภัณฑ์
29.เฉลยข้อ 4
แนวคิด
ระบบ (A) (M) (B) (M)
[ A] ( M) [ B] ( M)
ก 1 1
1
= 1 =1 =1
1
1
1
ข
2 2
=1 =1
2 2
ค
0.2 0.2
=2 =2
0.2 0.2
Ι ระบบที่เกิดสาร C มากที่สุด ภายในเวลาที่กำาหนดให้ ซึ่งไม่ชดเจน ดัง
ั
นั้นผู้เฉลย
จึงขอแยกพิจารณา ดังนี้
1. ถ้ากำาหนดเวลาเท่ากัน ในช่วงเวลาที่สารตั้งต้นในระบบ ก ,ข และ ค มีปริมาณ
พอที่จะทำาให้เกิดผลิตภัณฑ์ C ได้ ระบบที่เกิดผลิตภัณฑ์ C มากสุด ใช้ความ
เข้มข้นเป็น
เกณฑ์ในการพิจารณา เนื่องจากความสมเข้มข้น A และ B มากกว่าระบบอื่น
ดังนั้นจึงเกิด
สาร C ได้มากสุด
ข. ถ้ากำาหนดเวลาเท่ากัน ตังแต่เวลาที่ระบบ ก และ ค สารตั้งต้น
้
หมด
คงเหลือแต่สารตั้งต้นในระบบ ข มีพอทีจะเกิดปฏิกิริยาต่อไป ระบบที่จะเกิด
่
ผลิตภัณฑ์ C
มากที่สุด ใช้ปริมาณ ( จำานวนโมล ) สารตั้งต้นเป็นเกณฑ์ในการพิจารณา
เนื่องจากระบบสาร
ตังต้นมีจำานวนโมลมากที่สุดดังนั้นสามารถเกิดสาร
้ C ได้มากที่สด
ุ
35. ΙΙ จากโจทย์กำาหนด A+ B→ C และอัตราการเกิดปฏิกิริยาขึ้นกับ
[ A] และ [ B]
ดังนั้นระบบ ค มี [ A] และ [ B]
30.เฉลยข้อ 4
แนวคิด
เมื่อเพิ่มอุณหภูมิรบกวนสมดุล เนื่องจากเป็นสมดุลของปฏิกิริยาคาย
ความร้อน ปฏิกิริยา
เกิดการย้อนกลับมากขึ้น ที่สมดุลใหม่พบว่า [ COCL]
2 ลดลงส่วน
[ CO
] และ [ CI2]
เพิ่มขึ้นจากตัวเลือก ที่เป็นไปได้ข้อเดียวคือข้อ 4
31.เฉลยข้อ 1
แนวคิด แก๊ส X และ Y ทำาปฏิกิริยาได้แก๊ส Z ดังสมการ
X(g) + 3Y(g)
2Z(g)
เริ่ม 0.1 mol 0.1 mol 0 ปริมาตร
500 cm 3
ข้อ 1 ถูก เพราะเมื่อขยายปริมาตรเท่ากับเป็นการลดความดันของแก๊สเป็นผล
ทำาให้สมดุลเปลี่ยน
ย้อนกลับมากขึ้นไปด้านจำานวนโมลของแก๊สมากขึ้น เพื่อเพิม
่
ความดันให้มากขึ้น ที่
สมดุลใหม่จึง มีจำานวนโมลของ z ลดลง
ข้อ 2 ผิด เพราะค่า K แปรผันตรงกับ (Z) 2
และ K แปรผันกับ (X)
และ (Y) 3
ข้อ 3 ผิด เพราะที่ภาวะสมดุลจะมีแก๊ส X,Y และ Z ทุกชนิดใน
กระบอกสูบ ซึ่งแต่ละแก๊สจะ
มีปริมาณคงที่
36. ข้อ 4 ผิด เพราะจะเพิ่มสารตั้งต้น Y เป็น 0.3 mol ทำาปฏิกิริยากับ X
0.1 mol ถึงแม้ว่าเป็น
สัดส่วนกัน แต่ไม่ทำาปฏิกิริยาเคมีได้หมดพอดี เนื่องจาก
ระบบเกิดสมดุลได้ ระบบ
จะปรับตัวมันเอง ดังนั้นสารตั้งต้น Y และ ) จะเหลือคงที่
ขณะสมดุล
32. เฉลยข้อ 3
แนวคิด
ปฏิกิริยาที่ สมการของปฏิกริยา
ิ ปฏิกิริยาเคมี
1 กรด - เบส
2 กรด - เบส
3 2CH3 COOH + 2Na การแทนที่
2CH2 COONa + H2
4 กรด -
เบส
33.เฉลยข้อ 4
แนวคิด สาร A , B และ C เป็นสารสมมติไม่ทราบเป็นสารใด และไม่ระบุสถานะใน
การคำานวณเกี่ยวกับสมดุลคิดทุกสารหมด
การทดลองที่ 1 A + B
2C
เริ่ม ( mol / dm3 ) 0.04 0.04
0
37. เปลียน
่ ( mol / dm3 ) - ( 0.04 - 0.02 ) -0.02
+ 0.04
สมดุล ( mol / dm3 ) 0.02 0.02
0.04
[ C] 2
สูตร K =
[ A][ B]
× −
16 10 4
( 004 2
. )
แทนค่า K = = =4
( 002 002
. )( . ) × −
4 10 4
ทีอุณหภูมิ
่ 30oC คงที่ การทดลองที่ 1 และ 2 มีค่าคงทีสมดุล
่ ( K ) เท่ากัน
การทดลองที่ 2 A + B
2C
เริ่ม ( mol / dm3 ) 0.03
0.02 0
z z
เปลี่ยน ( mol / dm3 ) - -
2 2
z
Z Z
สมดุล ( mol / dm3 ) . −
003 . −
002
2 2
z
[ C] 2
สูตร K =
[ A][ B]
Z2
แทนค่า ; 4 = 003 Z 002 Z
. − . −
2 2
Z2
− −
6x10 2 − Z 4x10 2 − Z
4 =
2 2
4Z2
4 =
( − −
)(
6x10 2 − Z 4x10 2 − Z )
24 x 101 -4
- 10 x 10 -2
Z + Z 2
=Z 2
−4
2410
x
∴ Z= = 2.4 x 101-2 = 0.024 mol /
x −
1010 2
dm3
34. เฉลยข้อ 2
แนวคิด
นำ้าส้มสายชู
38. CH3COOH (aq) + NaOH (aq)
CH3COONa (aq) + H2O(l)
4.8 % มวล / ปริมาตร X % มวล / ปริมาตร
10 cm3 20 cm3
48
.
สารละลาย CH3COOH 100 cm3 มีเนื้อ CH3COOH = 4.8 g คิดเป็น
60
mol
48x 10
.
สารละลาย CH3COOH 10 cm3 มีเนื้อ CH3COOH mol
=
60 100
x
สารละลาย NaOH 100 cm3 มีเนื้อ NaOH = X g คิดเป็น mol
40
x 20
สารละลาย NaOH 20 cm3 มีเนื้อ NaOH = X mol
40 100
โมลNaOH 1
จากสมการ =
โมลCH 3COOH 1
20 mol
X
40100
x
= 1
48x 10mol
.
60 100
48x10 40100
. x
∴X = x = 1.6 % มวล / ปริมาตร
6x100 20
NaOH
สารละลาย มีความเข้มข้น = 1.6 % มวล / ปริมาตร
35. เฉลยข้อ 2
แนวคิด สารละลายกรด HA = 10 คือ
มีรอยละการแตกตัว
้
สารละลายกรด HA 100 mol / dm3 แตกตัว = 10
mol / dm 3
สารละลายกรด HA 1 x 10-3 mol / dm3 แตกตัว =
−3
101 10
xx
= 1 x 10-4 mol
100
HA ( aq ) + H2O ( l )
H3O ( aq ) + A ( aq ) Ka = ?
+ -
เริ่ม ( mol / dm )
3
1 x 10-3 -
0 0
เปลี่ยน ( mol / dm ) –1 x 10
3 -4
-
+1 x 10-4 +1 x 10-4
39. ( mol / dm3 ) (1 x 10-3–1 x 10-4 ) -
สมดุล
1 x 10-4 1 x 10-4
สูตร Ka =
[H3O+ ][A− ]
[ HA]
(1x10 4)(1x10 4) = 1x10 8 = 1.1110 5
− − −
x −
แทนค่า Ka =
(1x10 −1x10 ) 0.9x10
−3 −4 −3
สูตร pH = -log [ H3O+ ]
แทนค่า pH = -log ( 1 x 10
-4
) = 4
36. เฉลยข้อ 2
แนวคิด หลักการเลือกอินดิเคเตอร์สำาหรับการไทเทรดกรด - เบส
“ เลือกอินดิเคเตอร์ทมีช่วง
ี่ pH ของการเปลี่ยนสีตรงหรือใกล้เคียงกับ pH
ของเกลือที่
เกิดจากไทเทรตกรด - เบส “
ข้อ 1 ผิด เพราะไทเทรดเบสอ่อน NH4OH ด้วยกรดแก่ HCl เกอดเกลือ pH < 7 ใช้
อินดิเคเตอร์
ก หรือ ข
ข้อ 2 ถูก เพราะไทเทรดกรดแก่ HNO3 เป็นเบสแก่ NaOH เกิดเกลือ pH = 7 ใช้
อินดิเคเตอร์ที่มช่วง
ี
pH 3 - 11 จะใช้อินดิเคเตอร์เปลี่ยนช่วงกรดหรือ เบสได้ เช่น อินดิเค
เตอร์ ง
ข้อ 3 ผิด เพราะไทเทรตกรดอ่อน CH3COOH ด้วยเบสแก่ NaOH เกิดเกลือ pH > 7
ใช้อินดิเคเตอร์ ง
4
ข้อ ผิด เพราะไทเทรตเบสอ่อน NH4OH ( Kb = 1.8 x
10 -5
) ด้วยกรดอ่อน HCN ไม่
ควรไทเทรต เนืองจากเลือกอินดิเคเตอร์ยาก กรดอ่อนและเบส
่
อ่อน แตกตัวไม่ สม
บูรณ์จึงเกิดปฏิกิรยากันไม่สมบูรณ์
ิ
37. เฉลยข้อ 4
แนวคิด ข้อ 1 ผิด เพราะไม่เป็นสารละลายบัฟเฟอร์เนื่องจากปฏิกิริยาระหว่าง CaCO3 กับ
กรด HNO3
ดังนี้
CaCO3 ( s) + 2HNO3 (aq ) Ca (
NO3 )2 ( aq ) + H2CO3 ( aq )
40g 0.1 mol
40
= 0.4 mol
100
จากการพิจารณาพบว่ากรด HNO3 CaCO3
ถูกใช้หมดเหลือ
จากสมการ HNO3 2 mol ≡ CaCO3 1 mol
40. เกิด H2CO3 = 1 mol
1 01
x.
HNO3 0.1 mol ≡ CaCO3 1 mol =
2
0.05 mol
1 01
x.
เกิด H2CO3 =
2
= 0.05 mol
CaCO3 = 0.4 - 0.05 = 0.35 mol
เหลือ
และเกิด H2CO3 = 0.05 mol
หลังปฏิกิริยาเคมีเกิดกรดอ่อน H2CO3 0.05 mol เหลือเกลือกรดอ่อนของมัน
CaCO3 0.35 mol
เนื่องจาก CaCO3 ไม่ละลายนำ้าแลไม่แตกตัว เป็นไอออนในนำ้า จึงไม่สามารถมีสมบัติเป็น
บัฟเฟอร์ได้
2 ผิด เพราะไม่เป็นสารละลายบัฟเฟอร์ ปฏิกริยา NH4OH
ข้อ ิ กับ HCl ดังนี้
NH4OH ( aq ) + HCl ( aq ) NH4Cl (
aq) + H2O ( l )
1 mol / dm3 0.1 mol
100cm 3
1 100
x
= 0.1 mol
1000
จากการพิจารณาพบว่าปฏิกิริยาพอดีกันไม่เหลือสารตั้งต้นใด ดังนั้นหลัง
เกิดปฏิกิริยาสาร
เกิดขื้นไม่อยู่ในสภาพเป็นบัฟเฟอร์
3 ผิด
ข้อ เพราะสารละลายผสมไม่เป็นบัฟเฟอร์ เนื่องจาก CH3COOH เป็นกรดอ่อนไอออน
ลบ CH3COO
-
ไม่สามารถแทนที่ไอออนลบ Cl- ของเกลือ NH4Cl ได้ ซึ่ง Cl- เป็น
ไอออนลบของกรดแก่ HCI
ข้อ 4 ถูก เพราะเป็นสารละลายบัฟเฟอร์ ปฏิกิริยาระหว่าง H3PO4 กับ
NaOH เป็นดังนี้
H3PO4 ( aq ) + 3NaOH ( aq )
Na3PO4 ( aq ) + 3H2O ( l )
1 mol / dm3 1 mol / dm3
50 cm3 50 cm3
1 50
x 1 50
x
= 5 x 10-2 mol = 5 x 10-2 mol
1000 1000
จากการพิจารณาพบว่า NaOH ใช้หมด เหลือกรดอ่อน H3PO4 ดังนี้
41. จากสมการ NaOH 3 mol ≡ H3PO4 1 mol เกิด
Na3po4 1 mol
x −
1 5x10 2
NaOH 5 x 10 -2
mol ≡ H3PO4
3
mol
= 1.67 x 10-2
mol
x −
1 5x10 2
เกิด H3PO4 = 1.67 x 10-2 mol
3
หลังเกิดปฏิกิริยา
กรดอ่อน + เกลือของกรดอ่อน
H3PO4 = ( 5 x 10-2 - 1.67 x 110-2 )
เหลือ
= 3.33 x 10-2 mol
เกิด Na3PO4 = 1.67 x 10
-2
mol
38. เฉลยข้อ 4
แนวคิด แผนภาพแสดงปฏิกิริยาสาร A ละลายนำ้าดังนี้
สาร A + H2O H3PO4 +
HCl
( P, Cl )
9.8 g
10.95 g
13.75g
มวล Cl HCl
ใน = มวล Cl A
ในสาร
ถ้า HCl 1 mol มี Cl = 1 mol
HCl 36.5 g มี Cl = 35.5 g
35×10
.5 .95
HCl 10.95g มี Cl =
36
.5
= 10.65 g
สาร A 13.75 g มี Cl = 10.65 g
10 x100
.65
สาร A 100 g มี Cl =
13.75
= 77.45 ≈ 77.5 g
39. เฉลยข้อ
42. แนวคิด สารผสม 2 ชนิด เป็นสารละลาย เกิดปฏิกิริยาได้แก๊ส CO2 ผ่านลงในนำ้าปูนใส
Ca ( OH )2
เกิดสารละลายขุ่น แล้วนำาสารละลายผสมหลังเกิดปฏิกิริยาไประเหยจนแห้งเกิด
ตะกอนสีขวา
ข้อ ก ผิด เพราะ CuCO3 ไม่ละลายนำ้า เมื่อผสม HNO3 กับ
CuCO3 ไม่ละลายนำ้าเกิด
ตะกอนทำาปฏิกิริยาเกิดแก๊ส CO2 ทำาให้นำ้าปูนใสขุ่น แต่
สารละลายระเหยแห้งเกิดตะ
กอนสีฟ้าไม่ใช่ตะกอนสีขาว
ข้อ ข ถูก เพราะสารละลายผสม CH3COOH ( aq ) กับ NaHCO3
( aq ) เกิดปฏิกิริยาดังนี้
CHCOOH )+ H2O aq
(aq ( )
3
CH3COOH ( aq ) + NaHCO3 ( aq ) ระเหยแห้ดเ
กิ งตะกอนของ
CH COONaซึนเกลือ
3 ป็ ่งเ
+
CO2
(g )
Ca ( OH )2
( aq )
CaCO3 ตะกอนขุ่น
ข้อ ค ถูก เพราะสารละลายผสสม HCl ( aq ) กับ Na2CO3 (
aq ) เกิดปฏิกริยาดังนี้
ิ
2NaCl )+ H2O l)
(aq (
2HCl (aq ) + Na2CO3 ( aq ) ระเหยแห้ดเ อ
กิ งเกลื
ตะกอนสีNaCl
ขาว
+
CO2 (
aq ) Ca (
OH )2 ( aq )
ตะกอนขุ่น
CaCO3
ข้อ ง ผิด เพราะสารละลายผสม CO ( NH 2 )2 ( aq ) กับ
H2O ( l ) มีเอนไซม์เกิด
ปฏิกิริยาดังนี้
O ยูรเอส
ี
NH2 - C′′ - NH2 ( aq ) + H2O ( aq ) →
2NH (aq
3 )
ระเหยแห้งหลือกาก
ม่เ ไ
+ CO2 (
aq )
43. Ca ( OH ) 2 ( aq )
ตะกอนขุ่น
CaCO3
40.เฉลยข้อ 3
แนวคิด หินฟอสเฟต
3−
CaF2 . 3Ca3 ( po4 )2 เฉพาะส่วน PO 4 X + ( -2 x 4
X=
) = -3
Sb2S3 . 3H2O ( 2X ) + ( -2 x 3 ) + ( X = 0 )
3 x
= 0
Na2ZrSiO5 ( +1 x 2 ) + ( X ) + ( 4 ) + ( = x
X -2
5 ) = 0
ข้อ ก และ ค ถูก
ข้อ ข และ ง ผิด
ตัวเลือกข้อ 4 ข้อ ค และ ง ผิด
41.เฉลยข้อ 2
แนวคิด ให้สตีคลอไรด์ของธาตุ
ู M คือ MCln
MCln ( aq ) + nAgNO3 ( aq )
M ( NO3 ) n( aq ) + nAgCl( s )
0.05 mol / 500 cm3 0.10 mol / dm3
12.5 cm3 25 cm3-
00512
. x .5 01 25
.x
mol mol
500 1000
1.25 x 10-3 mol 2.5 x 10-3 mol
โมลAgNO
3 n
จากสมการ =
โมลMCl
n 1
44. 01 25
.x
1000
00512
. x .5 = n
500
∴n = 2
สูตรคลอไรด์ของ M คือ MCl2
42. เฉลยข้อ 4
แนวคิด ก . 2B3+ + H2A2 2B2+ + A2 + 2H+
red OX
ขั้วบวก ขั้วลบ
EO = E(O )
cell + − E(O ) = ( +0.8 ) - ( +0.68 ) =
−
+0.12 V
ข . A2 + 2H+ + 2Cl-
H2A2 + C2
red
OX
ขั้วบวก ขั้วลบ
EO = E(O )
cell + − E(O )
− = ( +0.68 ) + ( +1.07 )
= -0.39 V
ปฏิกิริยาไม่เกิดเองได้ เพราะ EO
cell เป็นติดลบ
ค. D4+ + B2+ D3+ +
B 3+
red
OX
ขั้วบวก ขั้วลบ
EO = E(O )
cell + − E(O ) = ( +1.45 ) - ( 0.08 ) =
−
+0.65 V
ปฏิกิริยาเกิดเองได้ เพราะ EO
cell เป็นติดบวก
ง. 2B3+ + 2C-
2B2+ + C2
red OX
ขั้วบวก ขั้วลบ
EO = E(O )
cell + − E(O )
− = ( +0.80 ) - ( +1.07 ) =
-0.27 V
ปฏิกิริยาเกิดเองได้ เพราะ EO
cell เป็นติดลบ
45. 43.เฉลยข้อ 3
แนวคิด ดุลสมการ
คำานวณ
2Cr ( OH )3 + 3CIO- + 4OH- 2CrO2- +3CI- + 5H2O
1 mol
NaOCI
X g
X mol
745
.
-
โมล ClO 3
จากสมการ =
โมล Cr OH 3
( ) 2
X 1 mol 3
74
.5 = X = 111.75
2
1 mol
≈ 111.8 g.
44.เฉลยข้อ 1
แนวคิด ผิด เพราะผงซักฟอกมีประสิทธิภาพซักล้างในนำ้ากระด้างดีกว่าสบู่ เพราะมีสารประกอบ
พวกฟอสเฟต ช่วยกำาจัด Ca2+ หรือ Mg2+ ในนำ้ากระด้างทั้งป้องกันไม่ให้ไปรวมตัวไอออนลบ
ของสารลด
ตึงผิวของนำ้า
ผงซักฟอกที่คาร์บอน ใน R แตกก้านสาขาจุลินทรีย์ไม่มีเอนไซม์ย่อยสะลายได้ ตกค้างในแหล่ง
นำ้า
ส่วนผงซักฟอกคาร์บอน ใน R ต่อกันเป็นสายยาวจุลินทรีย์มีเอนไซม์ย่อยสะ
ลายได้ไม่ตกค้างในแหล่งนำ้า
ผงซักฟอกโดยทั่วไปผสมฟอสเฟตประมาณ 30 – 50 % ฟอสเฟสเป็นปุ๋ย
เมื่ออยู่ใน
แหล่งนำ้าทำาให้สาหร่าย และวัชพืช เจริญงอกงาม แพร่พันธุ์รวดเร็ว ก่อให้เกิดปัญหาต่อสิ่งแวดล้อม
46. 45.เฉลยข้อ 2
แนวคิด เซลล์กัลวานิกที่เกิดจากครึ่งเซลล์ X;X2+ กับครึ่งเซลล์ Y / Y3+พบว่าครึ่งเซลล์
Y / Y3+
( Ε O = +0.90 งกว่า
Vสู ) มี Y เป็นขั้วบวก รับอิเล็กตรอนเป็นแคโทด เกิด
ปฏิกิริยา
Y3+ +3e- Y ครึ่งเซลล์
O
(. Vตำ ่
X / X2+ Ε = +003 ากว่ามี X ) เป็น
ขั้วลบให้อิเล็กตรอน
เป็นแอโนด เกิดปฏิกิริยา X X2+ +2e - เป็นปฏิกิริยารีดอกซ์เป็นดังนี้
3X O
+ 2Y 3+
3X3+ + 2YO
ตัวรีดิวซ์ ตัวออกซิไดส์
46.เฉลยข้อ 4
แนวคิด ปัจจัยที่มีผลต่อการแปลงสภาพเป็นโปรตีน : การให้ความร้อน ตัวทำาละลายอินทรีย์
ไอออนของโลหะหนัก การใช้กรดหรือเบส
47.เฉลยข้อ 1
แนวคิด ข้อ ก. เป็นฮอโมพอลิเมอร์มาจากมอนอเมอร์
ปฏิกิริยาพอลิเมอร์ไรเซชันแบบควบแน่น
ข้อ ข. เป็นฮอโมพอลิเมอร์ มาจากมอนอเมอร์ปฏิกิริยาพอนอเมอร์ไรเซชันแบบการ
เติม
ข้อ ค. เป็นโฮโมพอลิเมอร์ มาจากมอนอเมอร์
CH2 = CH - CH ≡ CH2 ปฏิกิริยาพอลิเมอร์ไร
เซชันแบบการเติม
ข้อ ง. เป็นไฮโมพอลิเมอร์ มาจากมอนอเมอร์ปฏิกิริยาพอลิเมอร์ไรเซชันแบบการ
เติม
48.เฉลยข้อ 3
แนวคิด ข้อ 1 ไม่เหมาะสมเพราะขวดนำ้าพลาสติกใส่นำ้ามันเบนซินไม่ได้ เนื่องจากนนำ้ามันเบนซิน
ละลายนำ้าได้
ข้อ 2 ไม่เหมาะสมเพราะถ้วยชามที่ผลิตจากกพอลิเอทิลินอุ่นอาาหารในเตา
ไมโครเวฟไม่ได้
เนื่องจากพอลิเอทิลีนละลายปนกับอาหารที่ใส่
ข้อ 3 เหมาะสมเพราะภาชนะที่เคลือบด้วยเทปรอน หรือพอลิเตรตระฟลูออโล
เอทิลินในการ
ทอดไข่ ทอดปลาได้ เทฟรอนมีจดหลอมเหลวสูง ไม่หลอมปนออก
ุ
มากับไข่และปลาที่
47. ทอด
ข้อ 4 ไม่เหมมาะสมเพราะกาารเก็บถ้วยชามพวกเมลินีนที่ชำารุดรวมกันกลับไป
ใช้ใหม่ไม่ได้
เนื่องจากเมลานีนเป็นพลาสติกพวกเทอร์มอเซตหลอมไม่ได้ เมื่อถูก
ความร้อนไม่
หลอมแต่ไม้ไฟไป
49.เฉลยข้อ 1
แนวคิด ข้อ ก การถลุงแร่ Zn ใช้หลัก Electrolysis สารละลาย ZnSO4 เกิดโลหะ
Zn ที่ขั้วแคโทด
ข้อ ข การถลุงแร่ Zn ใช้หลัก Electrolysis สารละลาย CdSO4 เกิด
โลหะ Cd ที่ขั้วแคโทด
50.เฉลยข้อ 2
แนวคิด ข้อ 1 เพราะมลพิษทางนำ้าที่เป็นสารจำาพวกฟอสเฟส ได้มาจากการใช้ปุ๋ยเคมี เช่น ปุ๋ย
ซุป
เปอร็ฟอสเฟต Ca(HPO4) ยากำาจัดวัชพืช เช่น ออแกนโนฟอสเฟต และผง
ซักฟอก เช่น
สารประกอบพวกฟอสเฟต
ข้อ 2 ผิด
สาร ย่อมาจากคำาว่า สูตรโครงสร้างแบบย่อย
CFC Chlorofluoro Carbons CFCl3 CF2Cl2 CHFCl2
(CFCS) CFC-11 CFC-12
CFC-22
DDT Dicslorodipspny
tricsloroetsane
Dioxin 2378–
Tetracslordipsenybenz
o
-p-dioxin
สารทั้ง 3 ชนิดเป็นสารพิษที่มีธาตุฮาโลเจนคือ Cl เป็นองค์ประกอบอยู่
ข้อ 3 ถูก เพราะแก๊ส CO2 ปริมาณมากเกิดจากการเผาไหม้เชื้อเพลิงเป็นสาเหตุหลักที่
ของการเกิดปรากฏการณ์เรือนกระจก
ข้อ 4 ถูก เพราะ O3 เป็นแก๊สที่เป็นพิษอยู่ในชั้นบรรยากาศระดับตำ่ามีประโยชน์ในการ
ป้องกันรังอัลตราไวโอเลตในบรรยากาศระดับสูง
ตอนที่ 2
1. เฉลย 23.75 g
มวลโมเลกุล การหามวลอะตอมของธาตุ
X4 124 4X = 124 X
= 31
48. Y2 32 2Y = 32
Y = 16
XY3-4 6.02 x 1023 ไอออนมีมวล = ( 31+16 x 4 ) g
23
951505
x . x10
XY3-4 1.505 x 1023 ไอออนมีมวล = = 23 g
.75
. x 23
60210
ข้อ 2 เฉลย 10 ชัวโมง
่
ปฏิกิริยาสังเคราะห์แสงดังนี้
( 1 ) 6nCO2 ( g ) + 6nH2O nC6H12 O6
+ 6nO2 + พลังงาน
X mol
( 2 ) Cn6 H12O6 ( C6H10O5) n +nH2O
1.62 g
จากสมการ ( 1 ) และ ( 2 )
โมล CO2 6n
=
โมล ( C6H10 5)
O 1
X mol
1.62 mol
= 6n
162n
162n
( X ) x = 6n
162
.
100 X = 6
-2
∴ X = 6 x 10 mol
แต่ การสังเคราะห์แสงใช้ CO2 6 x 10-3 mol ใช้เวลา =
1 ชัวโมง
่
การสังเคราะห์แสงใช้ CO2 6 x 10-2 mol ใช้เวลา
-2
1 x 6 x 10
= -3 ชัวโมง
่
6 x 10
49. ่
∴ ใช้เวลา 10ชั่วโมง
=
3. เฉลย 37.5 g
39.13 87
.
หาสูตรเอมพิรคัล
ิ C : H : O = : :
12 1
52
.17
โดยมวล
16
326
.
C: H : O =
326
.
87. 326
.
: : โดยมวล
326
. 3269
.
C : H : O = 1
: 2.669 : 1 โดยมวล
C : H : O = 3
: 8.007 : 3 โดยมวล
C : H : O = 3
: 8 : 3 โดยมวล
สูตรเอมพิรคัล
ิ = สูตรโมเลกุล = C3H8 O 3 มีมวล
โมเลกุล = 92
จุดเดือดของสารละลาย
m x 1000
1
สูตร ∆Tb = Ka x
m x M.W
2 1
แทนค่า ; ( 80.94 - 78.50 ) = 1.22 x
6.90 1000
x
m x 92
2
m2 = 37.5
g
มวลของเอทานอลในสารละลาย = 37.5 g
4. เฉลย 4.2 %
( 1 )
สารอินทรีย์ NH3 สลาย +
1.5 g
………..
( 2 ) NH3( g ) + HCl ( aq ) NH4Cl
(aq)
X g 0.5 mol / dm3
50 cm3
50. HCl ไทเทรตพอดีกับ NaOH (aq) ดังนี้
เหลือ
( 3 ) HCl ( aq) + NaOH (aq) NaCl (aq)
+ H2O ( l )
0.1 mol / dm3
30 cm3
01 x 30
. -3
= 3x 10 mol
1000
โมลHCl 1
จากสมการ ( 3 ) =
โมลNaOH 1
โมล HCl
แทนค่า -3 = 1
3 x 10
โมล HCl = 3 x 10-3
ใส่ HCl =
01550
. x
x -3
= 7.5 10 mol
1000
HCl เกิดปฏิกิริยาพอดีกับ NH3
ใช้ = ( 7.5 x 10-3 - 3 x 10-3 )
= 4.5 x 10-3 mol
โมล 3
NH 1
จากสมการ (2 ) =
โมล HCl 1
โมล 3
NH
แทนค่า -3 = 1
4.5 x 10
โมล NH3 = 4.5 x 10-3
และมวลNH3 = 4.5 x 10-3x 17 g
แต่มวล N ใน NH3 = มวล N ในสารอินทรีย์ 1.5 g จากสมการ ( 1 )
14
มวล N ในสารอินทรีย์ 1.5 g = x ( 4.5 x 10-3 x 17 ) g = 63
7
x 10-3 g
x −
63 10 3 x100
= 4.2g
สารอินทรีย์ 100 g มี N = 1. 5
ร้อยละของ N ในสารอินทรีย์ = 4.2
5. เฉลย 2.5 g
สารละลายCuSO4 500 cm3
Cuso4 ( aq )
มี CuSO4 . 5H2O ? g
0.1 mol -
CuSO4 . 5H2O มีความบริสุทธิ์
dm3
99.8%
51. สารละลาาย CuSO4 1000 cm3 มีเนื้อ CuSO4 = 0.1 mol
.×
01 500
สารละลาาย CuSO4 500 cm3 มีเนื้อ CuSo4 =
1000
= 0.05 mol
แต่ CuSO4 . 5 H2O = 1 mol
หรือ CuSO4 1 mol อยู่ ใน CuSO4 HO.4
1 005
x.
= = 005
. mol
1
มวล CuSO4
x 5H2O = 0.05 x 249.5=12.48g
CuOH4 . 5H2O 99.8 g อยู่ใน สาร CuSO4 .52H2O =
1010 g
CuHO44 .5H2O 12.48 g อยู่ในสาร CuHO44 .5H2O =
100 .48
x12
= 12 g
.5
99
.8
6. เฉลย 25.4 g
สูตรทั่วไปของกรดไขมัน อิมตัวคือ
่ CnH2n+1 COOH ถ้เป็นสูตรทั่วไป ของ
กรดไขมันไม่อิ่มตัว
มี C = C 1 แห่ง H ลดลง C = C2 แห่ง H ลดลง 4 จาก
สูตรไขมันกรดอิ่มตัว เป็นสูตร
Cn H ( 2n+1 ) -4 COOH คือ CnH2n-3 COOH
กรดไขมัน สูตรของกรดไขมันไม่อิ่มตัว จำานวนพันธะคู่ระหว่าง จำานวนโมลของ I2 ที่
C กับ C ใช้
ต่อกรดไขมัน 1
mol
A C15H29COOH 1 1
B C17H31COOH 2 2
C C17H33COOH 1 1
กรด A : กรด B : กรด C = 2 : 2 : 1 โดยโมล
กรด A : กรด B : กรด C = 2 x 254 : 1x 280 : 1x282
กรด A : กรด B : กรด C = 508 : 280 : 282
กรดไขมัน A B และ C มีมวลรวมกัน = 508 +280+282 = 1070 g
จากตารางจะได้ว่า กรดไขมัน A 1 mol = I2 1 mol มีมวล = 1 x 254 g
254
x2
กรดไขมัน A 2 mol = I2 = 508
g
1
กรดไขมัน B 1 mol = I2 2mol มีมวล =
2 x 254 g = 508 g
52. กรดไขมัน C 1 mol = I21 mol มีมวล = 1x
254 g = 254 g
ดังนั้นกรดไขมัน A , B , C หนัก 1070 g = I2 หนัก = 508 +
508 +254 = 1270 g
21.4% โดยมวล คือ
แต่นำ้ามันชนิดหนึ่งมีกรดไขมัน
นำ้ามัน 100 g มีกรดไขมัน A,B และ C = 21.4 g
นำ้ามันมีกรดไขมัน 1070 g = I2 1270 g
1270 × 21 . 4
กรดไขมัน 21.4 g = I2
1070
= 25.4 g
7. เฉลย 13.44 dm3 STP
ปฏิกิริยาแสดงการย่างแร่ ดังนี้
200 g (มี Sb2 S3 34%)
แร่พลวงเงิน
2Sb 2S (s) + 9O2(g) 2Sb 2O3(s)
+ 6SO2(s)
↓
↓
34
x 200 g = 68g
100
x dm3 STP
↓
↓
68
mol
340
x
mol
22 . 4
โมลSO 2 6
จากสมการ
โมลSb 2 S 3
=
2
x
22 . 4 = 3
68
340
68
∴x = 3x x 22.4 =
340
13.44 dm3 STP
ปริมาตรของแก๊ส SO2 ทีเกิดขึ้น
่ = 13.44 dm3STP
8. เฉลย 58%
1. ยาลดกรด (มี MgCO3 และแป้งผสมกัน) 1 g/H 2O 20 cm3
2,3 MgCO3(s) + 2HCl (aq)
MgCl2(aq) + H 2O(l) + CO2(g)
53. ↓ ↓
xg 1mol/dm3
↓ 20 cm3
↓
x 1 × 20
mol = 2 x 10-2 mol
84 1000
จากโจทย์ แสดงว่าเหลือ HCl ทีต้องเติม
่ H 2O เป็นสารละลาย
100cm 3
แล้วปิเปตมา 10cm 3
มาไทเทรตกับNaOH
MgCO3 ทำาปฏิกิริยาหมด เหลือ HCl ในการคำานวณใช้
MgCO3 เป็นเกณฑ์ในการคิด
MgCO3 1 mol = HCl 2 mol
x 2 x
MgCO3 84 mol ≡ HCl × mol
1 84
−2 x
เหลือ HCl = 2 × 10 − mol
42
−2 x
สารละลายผสม 100 cm3 มี HCl เหลือ = 2 × 10 − 42
mol
สารละลายผสม 10 cm3 มี HCl เหลือ =
−2 x 10
2 × 10 − 42 x mol
100
HCl(aq) + NaOH (aq)
NaCl (aq) + H 2O
↓ ↓
1 x
2 × 10 −2 − mol 0.2 mol-dm3
10 42
5 cm3
↓
0.2 × 5
mol
1000
โมลHCl 1
จากสมการ =
โมลNaOH 1
โมล HCl = โมล NaOH
1 x 0.2 × 5
2 × 10 −2 − =
10 42 1000
∴ x = 0.42 g
ยาลดกรด 1g มี MgCO3 ผสมอยู่ = 0.42 g มีแป้งผสม 0.58 g
0 . 58 × 100
ยาลดกรด 100 g มีแป้งผสม = g = 58 %
1








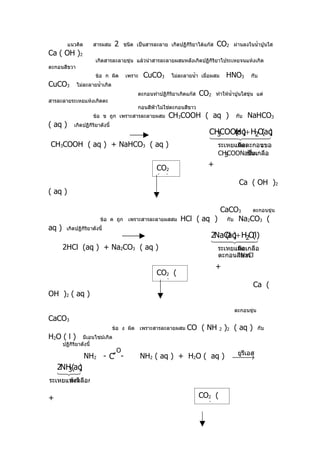
![32. ปฏิกิริยาข้อใดไม่ใช่ปฏิกิริยากรด - เบส
1.
2.
3. 2CH3COOH + 2Na → 2CH3COONa + H2
4. CH3COOH + NH3 → CH3COONH4
33. พิจารณาปฏิกิริยาสมมติตอไปนี้
่
A + B 2C
จากการทดลองได้ข้อมูลความเข้มข้นเริ่มต้นและความเข้มข้นที่สภาวะสมดุลของสารต่างๆใน
ปฏิกิริยานี้
การทดลองที่ ความเข้มข้นเริ่มต้น mol / dm3 ความเข้มข้นที่สภาวะสมดุล mol /
dm 3
[ A] [ B] [ C] [ A] [ B] [ C]
1. 0.04 0.04 0 0.02 M N
2. 0.03 0.02 0 X y z
ถ้าการทดลองที่ 1 และ 2 ที่ทำาอุณหภูมิ 30
o
C ค่า Z จะเป็นเท่าใด
1. 0.010 2. 0.012 3. 0.020
4. 0.024
34. นำ้าส้มสายชูตัวอย่างมีกรดอะซีตกอยู่รอยละ
ิ ้ 4.8/ โดยมวล ปริมาตร ในการไทเทรตนำ้าส้ม
สายชูกับสารละลายโซเดียมไฮดรอกไซด์พบว่านำ้าส้มสายชู 10 cm
3
ทำาปฏิกิริยาพอดีกับสารละลาย
NaOH 20 cm3 จงหาความเข้มข้นของสารละลาย NaOH ในหน่วยร้อยละโดยมวล /
ปริมาตร
1. 1.0 2. 1.6 3.
2.0 4. 2.4
35. สารละลายกรด HA ความเข้มข้น 1 × 10-3 mol / dm3 ปริมาตร 10 cm3 ร้อยละ
การแตกตัวของกรด
เท่ากับ 10 สารละลายนี้มี pH เท่าใด และมีค่า Ka โดยประมาณเท่าใด
pH K a (ประมาณ)
1. 3 1 × 10-3
2. 4 1.0 × 10-5
3. 5 1.0 × 10-4
4. 6 1.0 × 10-5](https://image.slidesharecdn.com/2543october-100715215019-phpapp02/85/slide-12-320.jpg)





















![เพราะมีจำานวน C อะตอมน้อยกว่า
ข้อ ค บิวทานอล ( CH3( CH2 ) 3 OH ) ละลายนำ้าได้ดีกว่าเพนทานอล ( CH3(
CH2 ) 4 OH ) เพราะ
มี C อะตอมน้อยกว่า
ข้อ ง โพรพาโนน ( CH3COCH3 ) ละลายนำ้าได้ดกว่า
ี ( CH3COOH ) โพรพา
นอล (CH3 CH2 CHO)
เพราะมีสภาพขั้วแรงกว่า
28.เฉลยข้อ 2
แนวคิด
จากกราฟ การเปรียบเทียบพลังงานสารตั้งต้น พลังงานก่อกัม
ของปฏิกิริยา และพลังงานผลิต ปฏิกิริยาแบบ มันต์ของ
ปฏิกิริยา
Ι พลังงานสารตั้งต้น ตำ่ากว่าพลังงาน
ผลิตภัณฑ์
ดูดความร้อน }I≥ II
ΙΙ พลังงานสารตั้งต้น สูงกว่าพลังงาน คายความร้อน
ผลิตภัณฑ์
29.เฉลยข้อ 4
แนวคิด
ระบบ (A) (M) (B) (M)
[ A] ( M) [ B] ( M)
ก 1 1
1
= 1 =1 =1
1
1
1
ข
2 2
=1 =1
2 2
ค
0.2 0.2
=2 =2
0.2 0.2
Ι ระบบที่เกิดสาร C มากที่สุด ภายในเวลาที่กำาหนดให้ ซึ่งไม่ชดเจน ดัง
ั
นั้นผู้เฉลย
จึงขอแยกพิจารณา ดังนี้
1. ถ้ากำาหนดเวลาเท่ากัน ในช่วงเวลาที่สารตั้งต้นในระบบ ก ,ข และ ค มีปริมาณ
พอที่จะทำาให้เกิดผลิตภัณฑ์ C ได้ ระบบที่เกิดผลิตภัณฑ์ C มากสุด ใช้ความ
เข้มข้นเป็น
เกณฑ์ในการพิจารณา เนื่องจากความสมเข้มข้น A และ B มากกว่าระบบอื่น
ดังนั้นจึงเกิด
สาร C ได้มากสุด
ข. ถ้ากำาหนดเวลาเท่ากัน ตังแต่เวลาที่ระบบ ก และ ค สารตั้งต้น
้
หมด
คงเหลือแต่สารตั้งต้นในระบบ ข มีพอทีจะเกิดปฏิกิริยาต่อไป ระบบที่จะเกิด
่
ผลิตภัณฑ์ C
มากที่สุด ใช้ปริมาณ ( จำานวนโมล ) สารตั้งต้นเป็นเกณฑ์ในการพิจารณา
เนื่องจากระบบสาร
ตังต้นมีจำานวนโมลมากที่สุดดังนั้นสามารถเกิดสาร
้ C ได้มากที่สด
ุ](https://image.slidesharecdn.com/2543october-100715215019-phpapp02/85/slide-34-320.jpg)
![ΙΙ จากโจทย์กำาหนด A+ B→ C และอัตราการเกิดปฏิกิริยาขึ้นกับ
[ A] และ [ B]
ดังนั้นระบบ ค มี [ A] และ [ B]
30.เฉลยข้อ 4
แนวคิด
เมื่อเพิ่มอุณหภูมิรบกวนสมดุล เนื่องจากเป็นสมดุลของปฏิกิริยาคาย
ความร้อน ปฏิกิริยา
เกิดการย้อนกลับมากขึ้น ที่สมดุลใหม่พบว่า [ COCL]
2 ลดลงส่วน
[ CO
] และ [ CI2]
เพิ่มขึ้นจากตัวเลือก ที่เป็นไปได้ข้อเดียวคือข้อ 4
31.เฉลยข้อ 1
แนวคิด แก๊ส X และ Y ทำาปฏิกิริยาได้แก๊ส Z ดังสมการ
X(g) + 3Y(g)
2Z(g)
เริ่ม 0.1 mol 0.1 mol 0 ปริมาตร
500 cm 3
ข้อ 1 ถูก เพราะเมื่อขยายปริมาตรเท่ากับเป็นการลดความดันของแก๊สเป็นผล
ทำาให้สมดุลเปลี่ยน
ย้อนกลับมากขึ้นไปด้านจำานวนโมลของแก๊สมากขึ้น เพื่อเพิม
่
ความดันให้มากขึ้น ที่
สมดุลใหม่จึง มีจำานวนโมลของ z ลดลง
ข้อ 2 ผิด เพราะค่า K แปรผันตรงกับ (Z) 2
และ K แปรผันกับ (X)
และ (Y) 3
ข้อ 3 ผิด เพราะที่ภาวะสมดุลจะมีแก๊ส X,Y และ Z ทุกชนิดใน
กระบอกสูบ ซึ่งแต่ละแก๊สจะ
มีปริมาณคงที่](https://image.slidesharecdn.com/2543october-100715215019-phpapp02/85/slide-35-320.jpg)

![เปลียน
่ ( mol / dm3 ) - ( 0.04 - 0.02 ) -0.02
+ 0.04
สมดุล ( mol / dm3 ) 0.02 0.02
0.04
[ C] 2
สูตร K =
[ A][ B]
× −
16 10 4
( 004 2
. )
แทนค่า K = = =4
( 002 002
. )( . ) × −
4 10 4
ทีอุณหภูมิ
่ 30oC คงที่ การทดลองที่ 1 และ 2 มีค่าคงทีสมดุล
่ ( K ) เท่ากัน
การทดลองที่ 2 A + B
2C
เริ่ม ( mol / dm3 ) 0.03
0.02 0
z z
เปลี่ยน ( mol / dm3 ) - -
2 2
z
Z Z
สมดุล ( mol / dm3 ) . −
003 . −
002
2 2
z
[ C] 2
สูตร K =
[ A][ B]
Z2
แทนค่า ; 4 = 003 Z 002 Z
. − . −
2 2
Z2
− −
6x10 2 − Z 4x10 2 − Z
4 =
2 2
4Z2
4 =
( − −
)(
6x10 2 − Z 4x10 2 − Z )
24 x 101 -4
- 10 x 10 -2
Z + Z 2
=Z 2
−4
2410
x
∴ Z= = 2.4 x 101-2 = 0.024 mol /
x −
1010 2
dm3
34. เฉลยข้อ 2
แนวคิด
นำ้าส้มสายชู](https://image.slidesharecdn.com/2543october-100715215019-phpapp02/85/slide-37-320.jpg)

![( mol / dm3 ) (1 x 10-3–1 x 10-4 ) -
สมดุล
1 x 10-4 1 x 10-4
สูตร Ka =
[H3O+ ][A− ]
[ HA]
(1x10 4)(1x10 4) = 1x10 8 = 1.1110 5
− − −
x −
แทนค่า Ka =
(1x10 −1x10 ) 0.9x10
−3 −4 −3
สูตร pH = -log [ H3O+ ]
แทนค่า pH = -log ( 1 x 10
-4
) = 4
36. เฉลยข้อ 2
แนวคิด หลักการเลือกอินดิเคเตอร์สำาหรับการไทเทรดกรด - เบส
“ เลือกอินดิเคเตอร์ทมีช่วง
ี่ pH ของการเปลี่ยนสีตรงหรือใกล้เคียงกับ pH
ของเกลือที่
เกิดจากไทเทรตกรด - เบส “
ข้อ 1 ผิด เพราะไทเทรดเบสอ่อน NH4OH ด้วยกรดแก่ HCl เกอดเกลือ pH < 7 ใช้
อินดิเคเตอร์
ก หรือ ข
ข้อ 2 ถูก เพราะไทเทรดกรดแก่ HNO3 เป็นเบสแก่ NaOH เกิดเกลือ pH = 7 ใช้
อินดิเคเตอร์ที่มช่วง
ี
pH 3 - 11 จะใช้อินดิเคเตอร์เปลี่ยนช่วงกรดหรือ เบสได้ เช่น อินดิเค
เตอร์ ง
ข้อ 3 ผิด เพราะไทเทรตกรดอ่อน CH3COOH ด้วยเบสแก่ NaOH เกิดเกลือ pH > 7
ใช้อินดิเคเตอร์ ง
4
ข้อ ผิด เพราะไทเทรตเบสอ่อน NH4OH ( Kb = 1.8 x
10 -5
) ด้วยกรดอ่อน HCN ไม่
ควรไทเทรต เนืองจากเลือกอินดิเคเตอร์ยาก กรดอ่อนและเบส
่
อ่อน แตกตัวไม่ สม
บูรณ์จึงเกิดปฏิกิรยากันไม่สมบูรณ์
ิ
37. เฉลยข้อ 4
แนวคิด ข้อ 1 ผิด เพราะไม่เป็นสารละลายบัฟเฟอร์เนื่องจากปฏิกิริยาระหว่าง CaCO3 กับ
กรด HNO3
ดังนี้
CaCO3 ( s) + 2HNO3 (aq ) Ca (
NO3 )2 ( aq ) + H2CO3 ( aq )
40g 0.1 mol
40
= 0.4 mol
100
จากการพิจารณาพบว่ากรด HNO3 CaCO3
ถูกใช้หมดเหลือ
จากสมการ HNO3 2 mol ≡ CaCO3 1 mol](https://image.slidesharecdn.com/2543october-100715215019-phpapp02/85/slide-39-320.jpg)