More Related Content
PDF
เล่ม 4 ปัจจัยที่มีผลต่อการเกิดปฏิกิริยาเคมี PPT
PDF
PPTX
PDF
เฉลย การแปลงคำอุปสรรค ม.3 , ม.4 PPTX
PDF
Evolution แก้ไขล่าสุดนักเรียน DOCX
แบบฝึกหัดารอ่านชื่อแอลเคน แอลีน อแลไคน์ What's hot
PDF
PPTX
PDF
PDF
PDF
PDF
4 กฎรวมแก๊ส กฎแก๊สอุดมคติ PPTX
PDF
PDF
PDF
PPT
PDF
PDF
แผนการจัดการเรียนรู้ เรื่อง ไขมันและน้ำมัน 3ชม. PDF
ความหลากหลายของสิ่งมีชีวิต02 PDF
PDF
PDF
ชุดกิจกรรมการเรียนรู้ชุดที่1พันธะโคเวเลนต์docx PDF
PDF
พันธะโคเวเลนต์ Covalent Bond PPTX
Viewers also liked
PDF
PDF
PDF
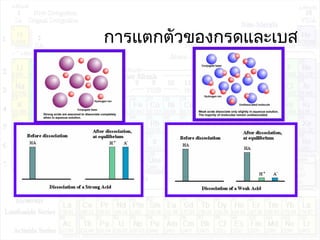
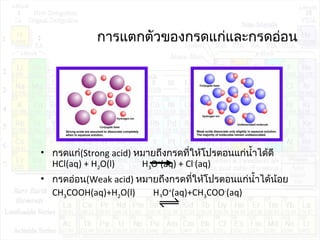
กรด เบสและสมดุลไอออน - Ion Equilibrium PDF
สื่อประกอบการสอนวิชาเคมีเพิ่มเติม3 ว30223 โดยครูนิติมา รุจิเรขาสุวรรณ PDF
เอกสารประกอบการเรียนรู้ ว40223acids base1 PPT
PDF
PPT
PDF
PDF
Lab 2 acid base titration and applications Similar to Acid and base
PPT
PDF
PDF
PPT
PPT
PPT
PDF
PPT
PPT
PDF
C5dduududidididididididiidjdssiwiqiiiaai PPT
PPT
PDF
PDF
PPTX
PPT
PPTX
PDF
PPT
PPTX









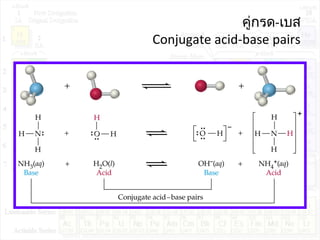
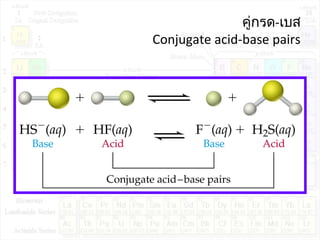


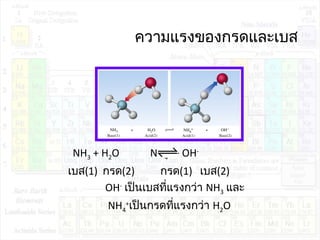
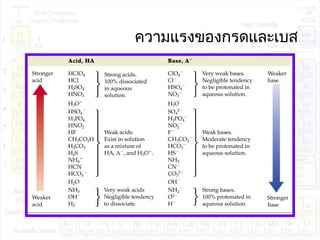
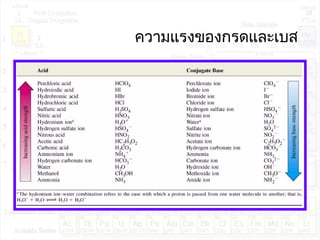
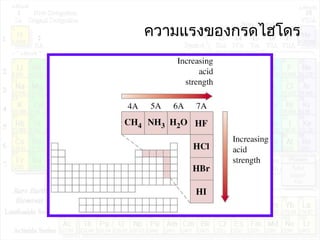


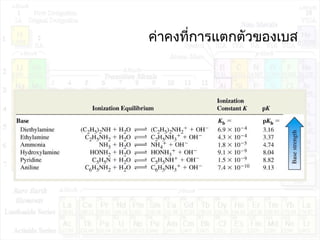
![ค่าคงที่การแตกตัวของกรด:Ka
HA + H2O H3O+
+ A-
K = ---------------
K.[H2O] = Ka = --------------
Ka : acid ionization constant
[H3O+
][A-
]
[HA][H2O]
[H3O+
][A-
]
[HA]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-29-320.jpg)
![ค่าคงที่การแตกตัวของเบส:Kb
B + H2O BH+
+ OH-
K = --------------
K.[H2O] = Kb = -------------
Kb : base ionization constant
[BH+
][OH-
]
[B][H2O]
[BH+
][OH-
]
[B]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-30-320.jpg)




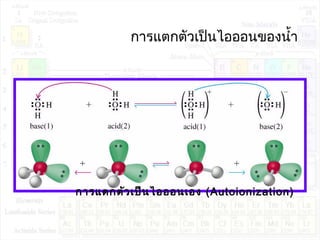
![ค่าคงที่การแตกตัวของนำ้า:Kw
H2O + H2O H3O+
+ OH-
K = ---------------
K.[H2O]2
= Kw = [H3O+
][OH-
]
Kw : ion product constant of water
[H3O+
][OH-
]
[H2O]2](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-40-320.jpg)
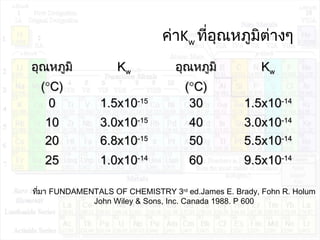
![ค่าคงที่การแตกตัวของนำ้า:Kw
Kw = [H3O+
][OH-
]
Kw = 1.0 x 10-14
ที่ 25°C
[H3O+
][OH-
] = 1.0 x 10-14
in a neutral solution : [H3O+
] = [OH-
]
[H3O+
] = [OH-
] = 1.0 x 10-7
mol/dm3](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-42-320.jpg)
![ตัวอย่างการคำานวณ
• ผลิตภัณฑ์ทำาความสะอาดที่ใช้ในบ้านเรือน
ชนิดหนึ่งมีความเข้มข้นของ OH-
เท่ากับ
0.0025 M จงคำานวณหาความเข้มข้นของ H3O+
[H3O+
][OH-
] = Kw = 1.0 x 10-14
[H3O+
] = (1.0x10-14
)/[OH-
]
= (1.0x10-14
)/0.0025
= 4.0x10-12
M](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-43-320.jpg)
![ความสัมพันธ์ระหว่างKa Kb และ Kw
ให้ HA และ A-
เป็นคู่กรด-เบส เมื่ออยู่ในนำ้า
แตกตัวดังนี้
HA+H2O H3O+
+A-
; Ka=
A-
+H2O HA+OH-
; Kb=
Kax Kb = x = Kw
[H3O+
][A-
]
[HA]
[HA][OH-
]
[A-
]
[H3O+
][A-
]
[HA]
[HA][OH-
]
[A-
]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-44-320.jpg)

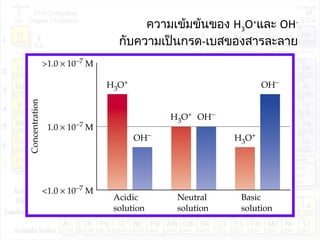

![pH ของสารละลาย
มาตรส่วน pH (pH scale) ใช้บอกความเป็นกรด-เบสของสารละลาย
pH = - log[H3O+
]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-48-320.jpg)
![pH และ pOH
pH = -log[H3O+
]
pOH = -log[OH-
]
pH + pOH = 14](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-49-320.jpg)







![สมดุลของอินดิเคเตอร์
HIn(aq) + H2O(l) H3O+
(aq) + In-
(aq)
Ka =
[H3O+
] = Ka
ในสารละลายกรด(H3O+
) เป็นสีของ HIn
ในสารละลายเบส(OH-
) เป็นสีของ In-
[H3O+
][In-
]
[HIn]
[HIn]
[In-
]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-58-320.jpg)
![การหาช่วง pH ของอินดิเคเตอร์
HIn + H2O H3O+
+ In-
รูปกรด รูปเบส
โดยทั่วไปตาของมนุษย์จะสามารถมองเห็นและ
บอกความแตกต่างของสีของรูปกรดและรูปเบสได้
เมื่อความเข้มข้นของรูปทั้งสองต่างกันอย่างน้อย
ประมาณ 10 เท่า ดังนั้น
• จะเห็นสีของรูปกรด เมื่อ [HIn]/[In-
] ≥ 10/1
• จะเห็นสีของรูปเบส เมื่อ [HIn]/[In-
] ≤ 1/10](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-59-320.jpg)
![การหาช่วง pH ของอินดิเคเตอร์
HIn + H2O H3O+
+ In-
[H3O+
] = Ka([HIn]/[In-
])
ดังนั้นสีของรูปกรด
[H3O+
] = Ka(10/1)
-log[H3O+
] = -logKa(10)
pH = pKa-1](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-60-320.jpg)
![การหาช่วง pH ของอินดิเคเตอร์
HIn + H2O H3O+
+ In-
[H3O+
] = Ka([HIn]/[In-
])
ดังนั้นสีของรูปเบส
[H3O+
] = Ka(1/10)
-log[H3O+
] = -logKa(10-1
)
pH = pKa+1
นั่นคือช่วงpH ที่เปลี่ยนสี = pKa±1](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-61-320.jpg)










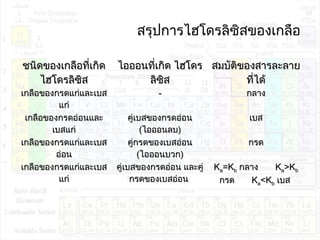
![ไฮโดรลิซิสของเกลือ
• เกลือที่เกิดจำกกรดแก่กับเบสแก่ NaCl KNO3
NaCl (aq) Na+
(aq) + Cl-
(aq)
KNO3(aq) K+
(aq) + NO3
-
(aq)
ไอออนที่เกิดจำกกำรแตกตัวของเกลือชนิดนี้ ไม่ทำำ
ปฏิกิริยำกับนำ้ำ
ในสำรละลำยจึงมี H3O+
= OH-
(เกิดจำกกำรแตกตัว
ของนำ้ำ)
[H3O+
]=[OH-
]=1.0x10-7
M
สำรละลำยมีสมบัติเป็นกลำง pH=7
H2
O
H2
O](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-73-320.jpg)
![ไฮโดรลิซิสของเกลือ
• เกลือที่เกิดจำกกรดแก่กับเบสอ่อน NH4Cl NH4NO3
NH4Cl(aq) NH4
+
(aq) + Cl-
(aq)
NH4
+
(aq)+H2O(l) H3O+
(aq)+NH3(aq)
2H2O(l) H3O+
(aq) + OH-
(aq)
ในสำรละลำยมี H3O+
>OH-
[H3O+
]>[OH-
]
สำรละลำยมีสมบัติเป็นกรด pH<7
H2
O](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-74-320.jpg)
![ไฮโดรลิซิสของเกลือ
• เกลือที่เกิดจำกกรดอ่อนกับเบสแก่ CH3COONa NaCN
CH3COONa(aq) CH3COO-
(aq) + Na+
(aq)
CH3COO-
(aq)+H2O(l) CH3COOH(aq)+OH-
(aq)
2H2O(l) H3O+
(aq) + OH-
(aq)
ในสำรละลำยมี H3O+
<OH-
[H3O+
]<[OH-
]
สำรละลำยมีสมบัติเป็นเบส pH>7
H2
O](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-75-320.jpg)

![ไฮโดรลิซิสของเกลือ
• เกลือที่เกิดจำกกรดอ่อนกับเบสอ่อน NH4CN
NH4
+
(aq)+H2O(l) H3O+
(aq)+NH3(aq)
Ka = 5.6x10-10
CN-
(aq)+H2O(l) HCN(aq) + OH-
(aq)
Kb = 1.6x10-5
Kb>Ka ดังนั้นสำรละลำยมี [H3O+
]>[OH-
]
สำรละลำยมีสมบัติเป็นเบส pH>7](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-77-320.jpg)
![ค่ำคงที่ไฮโดรลิซิส:Kh
(เกลือที่เกิดจำกกรดอ่อนและเบสแก่)
CH3COONa CH3COO-
+ Na+
CH3COO-
+ H2O CH3COOH + OH-
Kh =
Kh = x
Kh = Kw/Ka
[CH3COOH][OH-
]
[CH3COO-
]
[CH3COOH][OH-
]
[CH3COO-
]
[H3O+
]
[H3O+
]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-78-320.jpg)
![ค่ำคงที่ไฮโดรลิซิส:Kh
(เกลือที่เกิดจำกกรดแก่และเบสอ่อน)
NH4Cl NH4
+
+ Cl-
NH4
+
+ H2O H3O+
+ NH3
Kh =
Kh = x
Kh = Kw/Kb
[H3O+
][NH3]
[NH4
+
]
[OH-
]
[OH-
]
[H3O+
][NH3]
[NH4
+
]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-79-320.jpg)
![ค่ำคงที่ไฮโดรลิซิส:Kh
(เกลือที่เกิดจำกกรดอ่อนและเบสอ่อน)
• CH3COONH4 CH3COO-
+ NH4
+
• CH3COO-
+H2O CH3COOH+OH-
……………(1)
• NH4
+
+H2O H3O+
+NH3 ……………(2)
(1)+(2), CH3COO-
+NH4
+
CH3COOH+NH3
Kh = x
Kh =
[CH3COOH][NH3]
[CH3COO-
][NH4
+
]
[H3O+
][OH-
]
[H3O+
][OH-
]
Kw
Kax Kb](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-80-320.jpg)


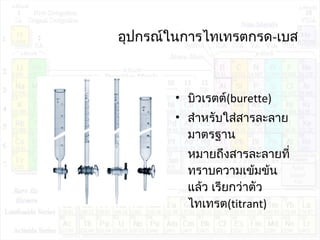




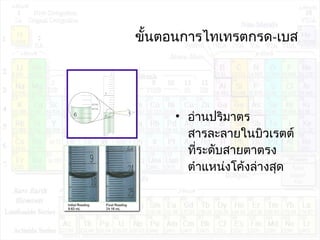









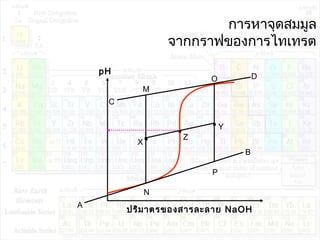



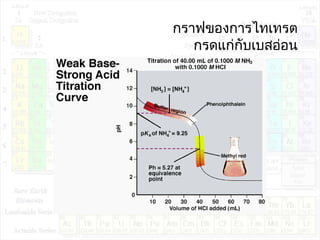
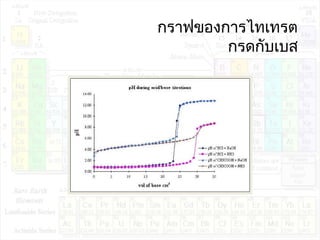







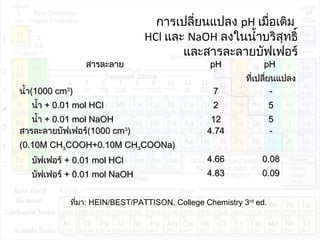

![pHของสารละลายบัฟเฟอร์
• บัฟเฟอร์กรด เช่น HA กับ A-
HA + H2O H3O+
+ A-
Ka = [H3O+
][A-
]/[HA]
[H3O+
] = Ka . [HA]/[A-
]
-log[H3O+
] = -logKa –log[HA]/[A-
]
pH = pKa – log[HA]/[A-
]
Henderson-Hasselbalch equation](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-118-320.jpg)
![pHของสารละลายบัฟเฟอร์
• บัฟเฟอร์เบส เช่น B กับ BH+
B + H2O BH+
+ OH-
Kb = [BH+
][OH-
]/[B]
[OH-
] = Kb . [B]/[BH+
]
-log[OH-
] = -logKb –log[B]/[BH+
]
pOH = pKb – log[B][BH+
]](https://image.slidesharecdn.com/acidandbase2553-130501061848-phpapp02/85/Acid-and-base-119-320.jpg)

