More Related Content
PDF
แบบฝึกหัดอัตราการเกิดปฏิกิริยาเคมี DOC
DOC
PPT
อัตราการเกิดปฏิกิริยาเคมี PDF
PDF
PDF
PDF
What's hot
PDF
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย PDF
PPT
PDF
Chemographics : Stoichiometry PDF
PDF
DOC
DOC
DOC
DOC
PDF
PDF
PPT
PPT
PDF
บทที่ 6 อัตราการเกิดปฏิกิริยา PPT
DOC
PDF
Similar to 1แผนที่2
DOC
DOC
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี PPT
DOC
PDF
PDF
ชุดกิจกรรมการเรียนรู้ เรื่องอัตราการเกิดปฏิกิริยาเคมี DOC
อัตราการเกิดปฎิกิริยาเคมี PDF
PDF
อัตราการเกิดปฏิกิริยาเคมี PDF
PDF
DOC
DOC
DOC
PDF
ชุดกิจกรรมวิทยาศาสตร์ เรื่อง ปฏิกิริยาเคมี รายวิชาเคมีพื้นฐาน กลุ่มสาระก... PDF
ชุดกิจกรรมวิทยาศาสตร์ เรื่อง ปฏิกิริยาเคมี รายวิชาเคมีพื้นฐาน ชั้นมัธยมศึก... PPS
DOC
DOC
1แผนที่2
- 1.
ใบความรู้ที่ ١
เรือง ความหมายของอัตราการเกิดปฏิกิริยาเคมี
่
***********************************************
********* ครูศักดิ์อนันต์ อนันตสุข
ปฏิกิริยาเคมีต่างๆ อาจจะเกิดขึ้นได้เร็วหรือช้าต่างกัน ซึ่งขึ้น
อยู่ กั บ ชนิ ด ของปฏิ กิ ริ ย า เช่ น การระเบิ ด ของดิ น ปื น จั ด ว่ า เป็ น
ปฏิกิริยาที่เกิดขึ้นได้เร็วมาก เพราะใช้เวลาไม่ถึงนาที การลุกไหม้
ของเชื้ อ เพลิ ง เช่ น ก๊ า ซหุ ง ต้ ม และนำ้า มั น เบนซิ น ก็ จั ด ว่ า เป็ น
ปฏิกิริยาที่ เกิ ดได้เ ร็ว การลุ กไหม้ ของถ่านหรื อของไม้ จั ดว่า เป็ น
ปฏิกิริยาที่เกิดขึ้นเร็วปานกลาง การเน่าเปื่อยของผัก ผลไม้ จัดว่า
เป็นปฏิกิริยาที่เกิดขึ้นค่อนข้างช้า การเกิดสนิมของเหล็กจัดว่าเป็น
ปฏิกิริยาที่เกิดขึ้นช้ามาก เป็นต้น
ปฏิกิริยาเคมีทมีความสำาคัญทางด้านอุตสาหกรรมก็เกี่ยวข้อง
ี่
กับอัตราการเกิดปฏิกิริยาเช่นเดียวกัน ปฏิกิริยาเหล่านี้ให้ผลผลิตที่
มีผลต่อสภาวะเศรษฐกิจของประเทศ จึงจำาเป็นที่จะต้องผลิตให้ได้
จำานวนมากและต้นทุนตำ่า ซึ่งต้องได้ผลผลิตมากที่สุดในเวลาน้อย
ที่สุดนั่นเอง ในการนี้จึงจำาเป็นที่จะต้องเรียนรู้เกี่ยวกับอัตราการเกิด
ปฏิ กิ ริ ย า เรี ย นรู้ ส ภาวะต่ า งๆ ที่ ใ ช้ ใ นการควบคุ ม การผลิ ต หรื อ
สภาวะต่างๆ ที่ใช้ควบคุมการเกิดปฏิกิริยา ต้องทราบว่าปัจจัยอะไร
บ้างที่มีผลต่ออัตราการเกิดปฏิกิริยา จะทำาให้ปฏิกิริยาเกิดเร็วหรือ
ช้าได้อย่างไร เป็นต้น
ความหมายของอัตราการเกิดปฏิกิริยาเคมี
อั ต ราการเกิ ด ปฏิ กิ ริ ย าเคมี หมายถึ ง “ปริ ม าณของ
ผลิ ตภั ณฑ์ ที่ เ กิ ดขึ้ น จากปฏิ กิ ริ ย าใน 1 หน่ ว ยเวลา” การวั ด อั ต รา
การเกิดปฏิกิริยาจึงเป็นการวัดปริมาณของผลิตภัณฑ์ที่เกิดขึ้นใน
1 หน่วยเวลา เขียนเป็นความสัมพันธ์ดังนี้
่
ปริมาณของผ ณฑ์ที ขึ้น
ลิตภั เพิ่ม
อัตราการเกิดปฏิกิริยาเคมี =
เวลา
เวลา หมายถึง ระยะเวลาที่เกิดปฏิกิริยา
เนื่องจากการเปลี่ยนแปลงทางเคมีเป็นกระบวนการที่สารตั้ง
ต้นเปลี่ยนเป็นผลิตภัณฑ์ การที่มีปฏิกิริยาเคมีเกิดขึ้นก็เนื่องจากมี
ผลิตภัณฑ์เกิดขึ้น ดังนั้นจึงสามารถวัดอัตราการเกิดปฏิกิริยาจาก
ปริ ม าณของผลิ ต ภั ณ ฑ์ ที่ เ กิ ด ขึ้ น ได้ ในระหว่ า งเกิ ด ปฏิ กิ ริ ย า ใน
- 2.
ขณะที่สารผลิตภัณฑ์เกิดเพิ่มมากขึ้น สารตั้งต้นก็จะลดลง ซึ่งการ
เปลี่ย นแปลงปริ ม าณของสารผลิ ต ภั ณ ฑ์ แ ละสารตั้ ง ต้ น มี ส่ ว น
สัมพันธ์กัน ยิ่งสารผลิตภัณฑ์เกิดขึ้นมากขึ้นเท่าใด สารตั้งต้นก็จะ
ยิ่งลดลงเท่านั้น ดังนั้นในกรณีที่ผลิตภัณฑ์ที่เกิดขึ้นไม่อยู่ในสภาพ
ที่ วั ด ปริ ม าณได้ ส ะดวก ก็ ส ามารถวั ด อั ต ราการเกิ ด ปฏิ กิ ริ ย าจาก
ปริมาณของสารตั้งต้นที่ลดลงแทน โดยอาศัยความสัมพันธ์ดังนี้
ปริมาณของผ ณฑ์ที ่
ลิตภั ลดลง
อัตราการเกิดปฏิกิริยาเคมี =
เวลา
เขียนรวมกันได้เป็น
่
ปริมาณของผ ณฑ์ที ขึ้น
ลิตภั เพิ่ม
อัตราการเกิดปฏิกิริยาเคมี =
เวลา
ปริมาณของผ ณฑ์ที ่
ลิตภั ลดลง
=
เวลา
ไม่ ว่ า จะวั ด อั ต รา การเกิ ด ปฏิ กิ ริ ย าจากสารตั้ ง ต้ น ที่ ล ดลง
หรือจากสารผลิตภัณฑ์ที่เพิ่มขึ้น จะต้องได้ค่าเท่ากัน เพราะเป็น
ปฏิกิริยาเคมีเดียวกัน การที่จะเลือกวัดปริมาณของสารตั้งต้น หรือ
ผลิตภัณฑ์ก็ขึ้นอยู่กับความสะดวกของการวัดปริมาณสารนั้นๆ
อาจจะกล่าวได้รวมๆ ได้ว่า อัตราการเกิดปฏิกิริยาก็คือ อัตรา
การเปลี่ยนแปลงปริมาณของสารตั้งต้นที่ลดลง หรืออัตราการเพิ่ม
ขึ้นของสารตั้งต้น
อัตราการเกิดปฏิกิริยา = อั ต ราการลดลงของสารตั้ ง
ต้น
= อัตราการเพิ่มขึ้นของสารผลิตภัณฑ์
วิธีการวัดอัตราการเกิดปฏิกิริยา
การวัดอัตราการเกิดปฏิกิริยาจะพิจารณาจากการวัดปริมาณ
ของสารตั้งต้น หรือสารผลิตภัณฑ์ก็ได้ ทั้งนี้ขึ้นอยู่กับความสะดวก
ของการทดลอง ขึ้นอยู่กับลักษณะและสมบัติของสารที่เกี่ยวข้อง
ตัวอย่างเช่น
1. ถ้าในปฏิกิริยาเกี่ยวข้องเป็นก๊าซ อาจจะวัดอัตราการเกิด
ปฏิกิริยาจากปริมาณของก๊ าซที่เ กิดขึ้น หรื อวั ดจากความดั นของ
ระบบที่เปลี่ยนแปลงไป
2. ถ้าในปฏิกิริยาเกี่ยวข้องกับสารที่มีสี อาจจะวัดอัตราการ
เกิ ด ปฏิ กิ ริ ย าจากความเข้ ม ข้ น ของสี ที่ ล ดลงของสาตั้ ง ต้ น หรื อ
ความเข้มของสีที่เพิ่มขึ้นของผลิตภัณฑ์
- 3.
3. ถ้าในปฏิกิริยาเกี่ยวข้องกับสารละลาย จะวัดอัตราการเกิด
ปฏิกิริยาจากความเข้มข้นของสารละลายที่เปลียนไป ่
นอกจากนี้ก็ยังสามารถวัดอัตราการเกิดปฏิกิริยาด้วยวิธีการ
อย่างอื่น เช่น ถ้าเป็นของแข็ง ใช้วิธีการชั่งมวล ถ้าเป็นสารละลาย
ที่เกี่ยวข้องกับกรด-เบส ใช้วิธีวัด pH เป็นต้น
เ หน่วยของเวลา ขึ้นอยู่กับชนิดของปฏิกิริยา ถ้าปฏิกิริยา
เกิ ด เร็ ว ก็ อ าจจะวั ด เป็ น นาที หรื อ วิ น าที ถ้ า เกิ ด ช้ า อาจจะวั ด เป็ น
ชั่วโมงหรือเป็นวัน
ช หน่วยของอัตราการเกิดปฏิกิริยา ขึ้นอยู่กับหน่วยปริมาณ
ของสารและเวลา เช่ น ก๊ า ซใช้ ลู ก บาศก์ เ ซนติ เ มตร/วิ น าที หรื อ
มิลลิเมตร/วินาที ของแข็งใช้เป็น กรัม/วินาที สารละลายใช้เป็น
โมล/ลิตร-วินาที เป็นต้น
เ หน่วยของอัตราการเกิดปฏิกิริยาที่ใช้มากคือ โมล/ลิตร-
วินาที
พิจารณาตัวอย่างการวัดอัตราการเกิดปฏิกิริยาต่อไปนี้
1. ปฏิ กิริ ยา Mg (s) + 2HCl (aq) → MgCl2 (aq) +
H2 (g)
ปฏิกิริยานี้อาจวัดอัตราการเกิ ดปฏิกิริย าจากสารต่า งๆ
ได้ดังนี้
I วัดจากปริมาตรของก๊าซ H2 ทีเกิดขึ้น ่
II วัดจากความดันของก๊าซ H2 ที่เกิดขึ้น
III วัดจากความเข้มข้นของ HCl ทีเกิดขึ้น ่
IV วัดจาก pH ของสารละลายที่เพิ่มขึ้น
V วัดจากมวลของ Mg ทีลดลง ่
VI วัดจากความเข้มข้นของ MgCl2 ทีเพิ่มขึ้น ่
ทุกวิธีสามารถนำาไปหาอัตราการเกิดปฏิกิริยาได้ทั้งสิ้น แต่วิธี
ที่สะดวกที่สุดสำาหรับปฏิกิริยาดังกล่าว คือวัดจากปริมาตรของก๊าซ
H2 ทีเกิดขึ้น
่
2. ปฏิกิริยา
2MnO4- (aq) +5C2O42- (aq) +16H+ (aq) → 2Mn2+
(aq) + 8H2O (l) + 10CO2(g)
อาจจะวั ดอั ตราการเกิ ดปฏิ กิริ ย าจากสี ข อง MnO4- ที่
หายไป หรือจาก pH ทีเพิ่มขึ้น ่
3. ปฏิกิริยา
2H+ (aq) + S2O32- (aq) → S (s) + SO2 (g) +
H2O (l)
- 4.
อาจจะวั ด อัต ราการเกิ ด ปฏิ กิ ริ ย าจากปริ ม าณของ
ตะกอน (ของแข็ง ) ของกำา มะถันที่ เกิ ดขึ้ น หรือ จากความเข้ มข้ น
ของสารละลาย (H+) ทีลดลง
่
การใช้สัญลักษณ์แทนอัตราการเกิดปฏิกิริยาเคมี
พิจารณาปฏิกิริยา
Mg(s) + H2SO4 (aq) → MgSO4 (aq) + H2 (g)
สามารถจะวัดอัตราการเกิดปฏิกิริยาได้ทั้งจากปริมาณ Mg
หรื อ H2SO4 ที่ ล ดลง และจากปริ ม าณของ MgSO4 หรื อ H2 ที่
เกิดขึ้น ซึ่งอาจจะเขียนสัญลักษณ์แทนอัตราการเกิดปฏิกิริยาจาก
สารต่างๆ ได้ดังนี้
ให้ [ ] แทนความเข้มข้น หรือปริมาตรของสาร
∆ แทนการเปลี่ยนแปลง
t แทนระยะเวลาที่เกิดปฏิกิริยา
เครื่องหมาย + แทนการเพิ่มขึ้น
- แทนการลดลง
ถ้าอัตราการเกิดปฏิกิริยาจากความเข้มข้นของกรด H2SO4 ที่
ลดลง
เมื่อเวลาเริ่มต้น (t1) มี H2SO4 เข้มข้น C1
เมื่อเวลา t2 มี H2SO4 เข้มข้น C2
เวลาทีใช้ =่ t2 - t1 = ∆ t
ความเข้มข้นที่ลดลง = C2 - C1 = - ∆ [H2SO4]
อั ต ร า ก า ร ล ด ล ง ข อ ง ก ร ด H2SO4 =
ปริมาณของผ ณฑ์ที ่
ลิตภั ลดลง
เวลา
∆[ H 2 SO 2 ]
∴ อั ต ร า ก า ร ล ด ล ง ข อ ง ก ร ด H2SO4 = −
∆t
………………………… (1)
ใ น ทำา น อ ง เ ดี ย ว กั น ส า ร อื่ น ๆ ก็ ส า ม า ร ถ ห า อั ต ร า ก า ร
เปลียนแปลงได้เช่นเดียวกัน
่
∆[ Mg]
อัตราการลดลงของ Mg = −
∆t
……………………… (2)
∆[ MgSO 4 ]
อัตราการเพิ่มขึ้นของ MgSO4 = +
∆t
………………………… (3)
- 5.
∆[H 2 ]
อัตราการเพิ่มขึ้นของ H2 = +
∆t
……………………… (4)
อัตราการเปลี่ยนแปลงปริมาณของสารตั้งต้นสมการ (1) -
(4) ยังไม่ใช่อัตราการเกิดปฏิกิริยาเป็นเพียงอัตราการ
เปลียนแปลงปริมาณของสารเท่านั้น แต่สามารถสร้างความ
่
สัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยากับอัตราการเปลี่ยนแปลง
ปริมาณของสารได้
พิจารณาจากสมการ Mg + H2SO4 → MgSO4 + H2
จะเห็นได้ว่า Mg ลดลง 1 โมล H2SO4 จะลดลง 1 โม
ลด้วย พร้อมกันนั้น MgSO4 และ H2 ก็จะเกิดขึ้นอย่างละ 1 โมล
ดังนั้นในเวลา 1 หน่วยเวลา การเปลียนแปลงปริมาณของ Mg,
่
H2SO4 , MgSO4 และ H2 จะเท่ากัน
เช่น ถ้าในเวลา 10 นาที ใช้ Mg ไป 0.1 โมล
0.1
อัตราการลดลงของ Mg = 10
= 0.01 โมล/นาที
อัตราการเปลี่ยนแปลงของ H2SO4 ,MgSO4 ,และ H2 ก็จะ
เป็น 0.01 โมล/นาที เช่นเดียวกัน
เนื่องจากอัตราการเปลี่ยนแปลงของสารทุกตัวต่อ 1 หน่วย
เวลามีค่าเท่ากัน ดังนั้นอัตราการเกิดปฏิกิริยาจึงสามารถพิจารณา
จากการเปลี่ยนแปลงของสารใดก็ได้ และในกรณีนี้อัตราการเกิด
ปฏิกิริยาจึงเท่ากับอัตราการเปลียนแปลงของสาร
่
อัตราการเกิดปฏิกิริยา = อัตราการลดลงของ H2SO4 =
∆[ H 2 SO 2 ]
−
∆t
= อัตราการลดลงของ Mg =
∆[ Mg]
−
∆t
= อัตราการเพิ่มขึ้นของ MgSO4 =
∆[ MgSO 4 ]
+
∆t
= อัตราการเพิ่มขึ้นของ H2 =
∆[H 2 ]
+
∆t
ถ้าให้ R = อัตราการเกิดปฏิกิริยา
∆[ H 2 SO 2 ] ∆[ Mg] ∆[ MgSO 4 ]
R = −
∆t
= −
∆t
= +
∆t
=
∆[H 2 ]
+
∆t
- 6.
ในกรณีที่ปฏิกิริยาเคมีนั้นเกี่ยวข้องกับสารมากกว่า 1 โมล
อัตราการเกิดปฏิกิริยาจะไม่เท่ากับอัตราการเปลี่ยนแปลงของสาร
นั้นจะต้องมีการเพิ่มแฟกเตอร์บางอย่างเข้าไปจึงจะหาอัตราการ
เกิดปฏิกิริยาได้
พิจารณาตัวอย่างของปฏิกิริยา
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2
(g)
∆[ Mg]
อัตราการลดลงของ Mg = −
∆t
………(1)
∆[ HCl]
อัตราการลดลงของ HCl = −
∆t
……….(2)
∆[ MgCl]
อัตราการเพิ่มขึ้นของ MgSO4 = +
∆t
..…….. (3)
∆[ H 2 ]
อัตราการเพิ่มขึ้นของ H2 = +
∆t
………(4)
อัตราการเปลี่ยนแปลงปริมาณของสารทั้ง 4 ชนิดจะไม่เท่า
กัน
จากสมการถ้าใช้ Mg 1 โมล จะต้องใช้ HCl 2 โมล จึงจะได้
MgCl2 และ H2 อย่างละ 1 โมล
สมมติว่าในเวลา 10 นาที ใช้ Mg ไป 0.1 โมล จะหาอัตราการ
เปลียนแปลงของสารต่างๆ ได้ดังนี้
่
จากสมการ ถ้าใช้ Mg 0.1 โมลจะใช้ HCl 0.2 โมล และได้
MgCl2 กับ H2 อย่างละ 0.1 โมล
0.1
อัตราการลดลงของ Mg = 10
= 0.01
โมล/นาที
0.2
อัตราการลดลงของ HCl = 10
= 0.02
โมล/นาที
0.1
อัตราการลดลงของ MgCl2 = 10
= 0.01
โมล/นาที
0.1
อัตราการลดลงของ H2 = 10
= 0.01
โมล/นาที
- 7.
จะเห็นได้ว่าอัตราการเปลียนแปลงของสารมีค่าไม่เท่ากัน ถ้า
่
อัตราการเกิดปฏิกิริยา คือ อัตราการเปลี่ ยนแปลงของสาร อั ตรา
การเกิดปฏิกิริยาที่คิดจากสารต่างๆ ก็จะมีค่าไม่เท่ากัน ซึ่งเป็นไป
ไม่ได้ ทังนี้เพราะ อัตราการเกิดปฏิกิริยาของปฏิกิริยาเคมีหนึ่งๆ จะ
้
ต้องมีค่าเท่ากันไม่ว่าจะคิดจากสารใด ดังนั้นอัตราการเกิดปฏิกิริยา
จึงไม่ใช่ อัตราการเปลี่ยนแปลงของสาร แต่สามารถคิดจากอัตรา
การเปลี่ยนแปลงของสารได้
การที่จะทำา ให้อัตราการเกิดปฏิกิริยามีค่าเท่ากันไม่ว่าจะคิด
จากสารใด ต้องมีการเพิ่มแฟกเตอร์บางอย่างเข้าไป
พิจารณากรณีของ HCl ถ้าคูณอั ตราการลดของ HCl ด้วย
1/2 จะพบว่าอัตราการเกิดเปลี่ยนแปลงจะเท่ากับสารอี่นๆ
0.2
1/2 x อั ต ราการลดลงของ HCl = 1/2 x 10
=
0.01 โมล/นาที
ตัวเลข “2” ที่เพิ่มเข้าไป ก็คือจำา นวนโมลของ HCl นั่นเอง
ซึ่ ง เ ป็ น แ ฟ ก เ ต อ ร์ ที่ ต้ อ ง เ พิ่ ม เ ข้ า ไ ป เ พื่ อ ทำา ใ ห้ อั ต ร า ก า ร
เปลียนแปลงเท่ากัน
่
อัตราการลดลงของ Mg = 0.01 โมล/
นาที
1/2 x อัตราการลดลงของ HCl = 0.01 โมล/
นาที
อัตราการลดลงของ MgCl2 = 0.01 โมล/
นาที
อัตราการลดลงของ H2 = 0.01 โมล/
นาที
จะเห็นว่าทุกกรณีเท่ากัน
ดังนั้น จึงเขียนอัตราการเกิดปฏิกิริยาเคมีจากสารต่างๆ ได้
ดังนี้
∆[ Mg] 1 ∆[ HCl] ∆[ MgCl] ∆[ H 2 ]
R = −
∆t
= −
2 ∆t
= +
∆t
= +
∆t
อัตราการเกิดปฏิกิริยาเคมีจึงมีส่วนสัมพันธ์กับอัตราการ
เปลียนแปลงของสารผ่านทางแฟกเตอร์เกี่ยวกับจำานวนโมล ซึ่ง
่
เขียนความสัมพันธ์ทวๆ ไป ได้ดังนี้
ั่
1
R = n
x อัตราการเปลียนแปลงของสาร
่
1 ∆[ X]
หรือ R = n
. ∆t
- 8.
เมื่อ
n = จำานวนโมลของสาร X
[X] = ความเข้มข้นของสาร X
ในกรณีที่พิจารณาสมการทั่วๆ ไป
aA + bB → cC + dD
จะเขียนอัตราการเกิดปฏิกิริยาไดเป็น
1 ∆[ A] 1 ∆[B] 1 ∆[C]
R = −
a ∆t
= −
b ∆t
= +
c ∆t
=
1 ∆[D]
+
d ∆t
ตัวอย่างเช่น
2A + 3B → C + 4D
1 ∆[ A] 1 ∆[ B] ∆[C] 1 ∆[D]
R = −
2 ∆t
= −
3 ∆t
= +
∆t
= +
4 ∆t
นั่นคือ อัตราการเกิดปฏิกิริยาเคมีคิดจากสารใดก็ได้ แต่ต้อง
คิดตามความสัมพันธ์ดังกล่าว
ประเภทของอัตราการเกิดปฏิกิริยา
อัตราการเกิดปฏิกิริยาแบ่งออกเป็น 2 ประเภท
ก. อัตราการเกิดปฏิกิริยาเฉลี่ย หมายถึง อัตราการเกิด
ปฏิกิริยาที่คิดจากการเปลียนแปลงปริมาณของผลิตภัณฑ์ (หรือ
่
สารตั้งต้น) ทังหมดใน 1 หน่วยเวลา
้
ข. อัตราการเกิดปฏิกิริยา ณ ขณะหนึ่ง หมายถึง อัตรา
การเกิดปฏิกิริยา ณ เวลาใดเวลาหนึ่ง ซึ่งคือ ค่าความชัน (slope)
ของกราฟระหว่างปริมาณของสารที่เปลี่ยนแปลงกับเวลา
โดยทัวๆ ไป อัตราการเกิดปฏิกิริยา 2 ประเภทจะไม่เท่ากัน
่
ในปฏิกิริยาทัวๆ ไป ช่วงแรกของการเกิดปฏิกิริยาจะค่อนข้าง
่
เร็วและค่อยๆ ช้าลงตามลำาดับ ทำาให้อัตราการเกิดปฏิกิริยา ณ
ขณะใดขณะหนึ่งมีค่าไม่เท่ากัน
ตัวอย่างที่ 1 จากปฏิกิริยา
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O
+ 5Cl2
จงเขียนอัตราการเกิดปฏิกิริยาในเทอมของสารต่างๆ
- 9.
วิธีทำา จากสมการทั่วๆ ไปที่กล่าวมาในตอนต้น สามารถเขียน
อัตราการเกิดปฏิกิริยาได้ดังนี้
1 ∆[KMnO 4 ]
อัตราการเกิดปฏิกิริยา = −
2 ∆t
=
1 ∆[ HCl] 1 ∆[ KCl]
−
16 ∆t
= +
2 ∆t
1 ∆[H 2 O] 1 ∆[ MnCl 2 ]
= +
8 ∆t
= +
2 ∆t
=
1 ∆[Cl 2 ]
+
5 ∆t
ตัวอย่างที่ 2 เมื่อสาร A ทำาปฏิกิริยากับสาร B ได้ผลิตภัณฑ์เป็น
สาร C เพี ย งชนิ ด เดี ย วจากการทดลองพบว่ า อั ต ราการเกิ ด
ปฏิกิริยา ถ้าคิดจากสาร A จะเท่ากับ 1/2 เท่าของอัตราการลด
ลงของสาร A ถ้าคิดจากสาร B จะเท่ากับ 2 เท่าของอัตราการ
ลดลงของสาร B และถ้าคิดจากสาร C จะเท่ากับ 1/3 เท่าของ
อัตราการเพิ่มขึ้นของสาร C สมการที่ใช้แสดงปฏิกิริยานี้คืออะไร
?
1 ∆[A ]
วิธีทำา จากโจทย์ อั ต ราการเกิ ด ปฏิ กิ ริ ย า = −
2 ∆t
=
2 ∆[B] 1 ∆[C]
−
1 ∆t
= +
3 ∆t
เลขที่อยู่ขางหน้าอัตราการเปลียนแปลงของสารเกี่ยวข้อง
้ ่
1 ∆[ A]
กับจำานวนโมลของสารนั้น ๆ ใน สมการ เช่น −
2 ∆t
แสดงว่า
ในสมการจะมี A 2 โมล
∴ เขียนเป็นสมการได้ดังนี้
2A + 1/2 B → 3C
หรือ 4A + B → 6C
ตัวอย่างที่ 3 เมื่อนำาก๊าซ N2O5 ไปละลายในตัวทำาละลายอินทรีย์
ชนิดหนึ่ง N2O5 จะสลายตัวดังสมการ
2N2O5 (g) → 4NO2 (g) + O2 (g)
ถ้ า NO2 ละลายในตั ว ทำา ละลายอิ น ทรี ย์ นั้ น และ O2 ไม่
ละลาย วิธีการวัดอัตราการเกิดปฏิกิริยาต่อไปนี้ วิธีใดบ้างใช้ได้
ก. วัดปริมาตรของก๊าซ O2 ทีเกิดขึ้น ค. วัดการนำา ไฟฟ้า
่
ของสารละลาย
ข. วัดความดันของก๊าซ O2 ที่เกิดขึ้น ง . วั ด ม ว ล ข อ ง
สารละลายที่ลดลง
- 10.
วิธีทำา ก. ใช้วัดอัตราการเกิดปฏิกิริยาได้ เนื่องจากเกี่ยวข้อง
กับก๊าซ จึงสามารถวัดอัตราการเกิดปฏิกิริยาจากปริมาตรของก๊าซ
O2 ทีเพิ่มขึ้นได้
่
ข. ใช้ วั ด อั ต ราการเกิ ด ปฏิ กิ ริ ย าได้ การวั ด อั ต ราการเกิ ด
ปฏิกิริยาของระบบที่มีก๊าซ นอกจากจะวัดจากปริมาตรของก๊าซที่
เพิ่มขึ้นแล้ว ยังสามารถวัดความดันของระบบที่เพิ่มขึ้น หรือลดลง
ได้อีกด้วย
ค. ใช้ วั ด อั ต ราการเกิ ด ปฏิ กิ ริ ย าไม่ ไ ด้ เนื่ อ งจากเป็ น การ
ละลายในตัวทำาละลายอินทรีย์ จึงไม่มีการแตกตัวเป็นไอออน ดัง
นั้นสารละลายจึงไม่นำา ไฟฟ้า ทำา ให้วัดอัตราการเกิดปฏิกิริยาจาก
การนำาไฟฟ้าไม่ได้
ง. ใช้วั ดอั ตราการเกิ ดปฏิ กิริ ย าได้ เนื่ อ งจากในขณะที่ เ กิ ด
ปฏิ กิริ ย า จะได้ ก๊ า ซ O2 ซึ่ ง ไม่ล ะลายในตั ว ทำา ละลาย สามารถ
แยกออกไปได้ ทำาให้มวลของระบบลดลง จึงสามารถวัดอัตราการ
เกิดปฏิกิริยาจากมวลทีลดลงได้
่
ตั ว อย่ า งที่ 4 จากปฏิ กิ ริ ย าต่ อ ไปนี้ 2Al + 3H2SO4 →
Al2(SO4)3 + 3H2
จากการทดลองพบว่ า ในเวลา 10 นาที ใช้ Al หมดไป
13.5 กรัม
ก. จงคำานวณอัตราการเปลี่ยนแปลง H2SO4 และ H2 เป็น
โมล/ลิตร
ข. จงคำานวณอัตราการเกิดปฏิกิริยาเฉลี่ยจากการทดลองนี้
วิธีทำา ก. หาจำานวนโมลของ H2SO4 และ H2 ที่เกี่ยวข้อง
ใ น ป ฏิ กิ ริ ย า จ า ก Al ก่ อ น แ ล้ ว จึ ง นำา ไ ป คำา น ว ณ อั ต ร า ก า ร
เปลียนแปลง
่
13.5
จากโจทย์ใช้ Al 13.5 กรัม = 27
= 0.5
โมล
จากสมการถ้าใช้ Al 2 โมล ต้องใช้ H2SO4 = 3
โมล
3
∴ ใช้ Al 0.5 โมล ต้องใช้ H2SO4 = x
2
0.5 = 0.75 โมล
ในทำานองเดียวกัน จะเกิด H2 = 0.75 โมล
ในเวลา 10 นาที เกิด H2 = 0.75 โมล
- 11.
0.75
∴ อัตราการเกิด H2 = = 0.075 โมล/
10
นาที
0.75
และอั ต ราการลดลงของ H2SO4 = 10
= 0.075
โมล/นาที
ข. คำานวณอัตราการเกิดปฏิกิริยา
1 ∆[H 2SO 4 ] 1
อั ต ราการเกิ ด ปฏิ กิ ริ ย า = −
3 ∆t
= 3
x
0.075 = 0.025 โมล/ลิตร
หมายเหตุ อาจจะคิดอัตราการเกิดปฏิกิริยาจากสารตัวอื่น
ก็ได้ จะได้คำาตอบเท่ากัน
ตัว อย่ างที่ 5 จากการทดลองหาอัตราการเกิ ดปฏิกิริย าระหว่าง
Mg กับ HCl ตามสมการ
Mg + 2HCl → MgCl2 + H2
โดยการเก็บก๊าซ H2 จากการแทนที่สารละลายดังในรูป
ผลการทดลองได้ดังนี้
ปริมาตร H2 เวลา ปริมาตร H2 เวลา (s)
(cm )3
(s) (cm3)
1 7 4 32
2 15 6 60
3 23 8 105
ก. จงคำานวณอัตราเฉลี่ยของการเกิดก๊าซ H2
ข. จงคำา นวณอัตราการเกิดก๊าซ H2 ระหว่างเวลา 23 - 32
วินาที
ค. จงคำานวณอัตราการเกิดก๊าซ H2 ณ วินาทีที่ 50
วิธทำาก. คำานวณอัตราเฉลี่ย
ี
- 12.
ปริมาตร2 ทั้งหมด
H
อัตราเฉลี่ย =
เวลาทั้งด
หม
8
= 105
= 0.076 cm3/s
ข. คำานวณอัตราการเกิด H2 ในช่วง 23 - 32 วินาที
V2 − V1 ∆V
อัตราการเกิดปฏิกิริยา = t 2 − t1 = ∆t
4−3
= 32 − 23
= 0.11 cm3 /s
ค. คำานวณอัตราการเกิด H2 ที่ 50 วินาที
V2 − V1 ∆V
จากสูตร อัตราการเกิดปฏิกิริยา = t 2 − t1 = ∆t
ถ้ า เขี ย นกราฟระหว่ า งปริ ม าตรของก๊ า ซ H2 ที่ เ กิ ด ขึ้ น กั บ
เวลาที่ใ ช้ โดยให้ แ กนตั้ ง แทนปริ มาตร และแกนนอนแทนเวลา
∆V
ค่า ∆t
ก็คือความชัน (slope)ของกราฟนั่นเอง ดังนั้นเมื่อต้องการ
หาอั ต ราการเกิ ด ปฏิ กิ ริ ย า ณ ขณะใดขณะหนึ่ ง จะทำา ได้ โ ดยการ
หาความชันจากกราฟ ณ จุดหนึ่งๆ
จากข้อมูลที่โจทย์กำาหนดให้ เขียนเป็นกราฟได้ดังนี้
เมื่อต้องการหาอัตราการเกิดปฏิกิริยา ณ เวลา 50 วินาที ก็
ทำา ได้โดยลากเส้นขนานกับแกนตั้งจากจุด 50 วินาที ขึ้นไปตัด
กราฟที่จุด A หลังจากนั้นลากเส้นสัมผัสให้ผ่านจุด A แล้วหาค่า
ความชั น (slope) ที่ จุ ด A ค่ า ความชั น ก็ คื อ ค่ า อั ต ราการเกิ ด
ปฏิกิริยา ณ เวลานั้น
∆V V2 − V1
จากกราฟ ความชัน = ∆t
= t 2 − t1
8.9 − 3.4
= 100 − 20
= 0.069 cm3/s
- 13.
เพราะฉะนั้นอัตราการเกิดปฏิกิริยาที่เวลา 50 วินาที= 0.069
cm /s
3
จากตั ว อย่ า งของปฏิ กิ ริ ย า Mg + 2HCl → MgCl2 +
H2 จะเห็ นได้ว่า อัตราการเกิ ดปฏิกิริย าในช่ว งเวลาต่ า งๆ มีค่า ไม่
เท่ากัน ในตอนเริ่มต้นปฏิกิริยาจะเกิดเร็วและค่อยๆ เกิดช้าลงตาม
ลำา ดั บ เห็ น ได้ จ ากลั ก ษณะของกราฟซึ่ ง มี ค่ า ความชั น สู ง มากใน
ตอนแรก (ความชั น ของกราฟ คื อ ค่ า อั ต ราการเกิ ด ปฏิ กิ ริ ย า ณ
ขณะนั้น) แล้วค่อยๆ ลดลงตามลำาดับ
นอกจากจะวัดอัตราการเกิดปฏิกิริยาจากปริมาตรของก๊าซ H2
ที่เกิดขึ้นแล้ว ยังสามารถวัดอัตราการเกิดปฏิกิริยาจากปริมาณของ
Mg และ HCl ทีลดลงได้ ่
ในกรณีของ Mg เมื่อเกิดปฏิกิริยา Mg จะถูกใช้ไปทำา ให้
มวลของ Mg ที่เหลือลดลง การเขียนกราฟแสดงอัตราการเกิด
ปฏิกิริยาอาจจะทำาได้หลายลักษณะดังนี้
กรณีที่ 1 เมื่อใช้ Mg มากเกินพอ
หลั ง จากเกิ ด ปฏิ กิ ริ ย าในช่ ว งระยะเวลาหนึ่ ง Mg จะทำา
ปฏิกิริยากั บกรด HCl จน HCl ถูกใช้หมดไป หลัง จากนั้น ก็จ ะไม่
เกิดปฏิกิริยาต่อไปอีก เนื่องจากสาตั้งต้นเหลือแต่ Mg เพียงอย่าง
เดียว
การเขียนกราฟเพื่อแสดงอัตราการเกิดปฏิกิริยาอาจจะทำาได้
2 แบบ
ก. กราฟระหว่างมวลของ Mg ที่ใช้กับเวลา
เมื่อถึงเวลา t1 กรด HCl จะใช้หมดไป ไม่เกิดปฏิกิริยาต่อ
ไปอีก ดัง นั้น มวลของ Mg ที่ใ ช้ไ ปจึ งเทาเดิ มและมี ค่า คงที่ ดัง ใน
กราฟ
- 14.
ข. กราฟระหว่างมวล Mgที่เหลือกับเวลา
นอกจากจะเขี ย นกราฟระหว่ า งมวล Mg ที่ใ ช้ กับ เวลาแล้ ว
ยังสามารถเขียนกราฟระหว่างมวล Mg ที่เหลือกับเวลาได้
t2 คือ เวลาที่ HCl ถูกใช้หมดไป ปฏิกิริยานี้สิ้นสุดแล้ว มวล
ของ Mg ทีเหลือจึงมีปริมาณคงที่ดงในกราฟ
่
กรณีที่ 2 เมื่อใช้ HCl มากเกินพอ
ในกรณี นี้ จ ะเหลื อ HCl ส่ ว น Mg ใช้ ห มดไป ซึ่ ง เมื่ อ Mg
ใช้ ห มดไปปฏิ กิ ริ ย าจะสิ้ น สุ ด การเขี ย นกราฟแสดงอั ตราการเกิ ด
ปฏิกิริยาในเทอมของ Mg ก็ทำาได้ 2 แบบเช่นเดียวกัน
ก. กราฟระหว่างมวล Mg ที่ใช้กับเวลา
จะเห็นว่า Mg จะถูกใช้ไปในการทำา ปฏิกิริยากับ HCl จนหมด
เมื่อเวลา t3 Mg ทีใช้จึงมากที่สุด
่
ข. กราฟระหว่างมวล Mg ที่เหลือกับเวลา
- 15.
จะเห็นได้ว่าช่วงแรกจะเหลือ Mg มากแต่เมื่อถึงเวลา t4
ปฏิกิริยาจะเกิดสมบูรณ์เหลือ Mg เป็นศูนย์หรือใช้ Mg หมดไป
ในกรณีที่เป็นปฏิกิริยาทั่วๆ ไป เช่นการสลายตัวของ A ตาม
สมการ A B จะพิจารณาอัตราการเกิดปฏิกิริยาได้จากความ
เข้ ม ข้ น เมื่ อ เกิ ด ปฏิ กิ ริ ย า A ซึ่ ง เป็ น สารตั้ ง ต้ น จะลดลงอย่ า ง
รวดเร็วและค่อยๆ ช้าลง ในขณะเดียวกัน B ซึ่งเป็นผลิตภัณฑ์ที่จะ
เกิดขึ้นอย่างรวดเร็วและค่อยๆ ช้าลงตามลำาดับ
การเขียนกราฟแสดงอัตราการเกิดปฏิกิริยาอาจจะกระทำา ได้
หลายแบบ ทั้ ง ในเทอมของความเข้ ม ข้ น ของสารแต่ ล ะชนิ ด กั บ
เวลา หรือในเทอมของอัตราการเกิดปฏิกิริยากับเวลา นอกจากนี้
ยังต้องพิจารณาด้วยว่า ปฏิกิริยานั้นเกิดขึ้นแบบสมบูรณ์ หรือแบบ
มีภาวะสมดุล
ก. ถ้าเป็นปฏิกิริยาที่เกิดสมบูรณ์ ไม่มีภาวะสมดุลเกิดขึ้นจะ
เขียนกราฟได้ดังนี้
เมื่ อ ถึ ง ระยะเวลาหนึ่ ง สารตั้ ง ต้ น บางชนิ ด จะถู ก ใช้ ห มดไป
ปฏิกิริยาจึงสิ้นสุด จะเห็นได้ว่า เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว อัตรา
การเกิดปฏิกิริยาจะเท่ากับศูนย์ เพราะไม่มีปฏิกิริยาเกิดขึ้นอีก
ข. ถ้าเป็นปฏิกิริยาที่มีภาวะสมดุล เกิ ดขึ้ น จะเขีย นกราฟได้
ดังนี้
- 16.
กราฟในเทอมของความเข้มข้น เมื่อถึงเวลา t1จะเห็นได้วา ่
ความเข้มข้นของ A และ B มีค่าคงที่ แสดงว่าเวลา t1 คือเวลาที่
ระบบกำาลังอยู่ในภาวะสมดุล
กราฟในเทอมของอั ต ราการเกิ ด ปฏิ กิ ริ ย า เมื่ อ ถึ ง เวลา t2
อัตราการเกิดปฏิกิริยาไปข้างหน้า (A→B) จะเท่ากับอัตราการ
เกิ ด ปฏิ กิ ริ ย าย้ อ นกลั บ (B→A) แสดงว่ า ระบบกำา ลั ง อยู่ ใ นภาวะ
สมดุล
ตั ว อย่ า งที่ 6 จากปฏิ กิ ริ ย า A(s) + B (g) C (s) +
D(g)
อัตราการเกิดปฏิกิริยาของปฏิกิริยาไปข้างหน้า ในเทอมของ
ความเข้มข้นกับเวลา และในเทอมของอตราการเกิดปฏิ กิริ ยากับ
เวลาจะเขียนกราฟได้อย่างไร ?
วิธีทำา
เนื่องจากเป็น ปฏิ กิริ ยาไปข้างหน้ า A และ B ซึ่ง เป็น สารตั้ ง
ต้นจะทำาปฏิกิริยากัน ได้ผลิตภัณฑ์เป็น C และ D นั่นคือ ความเข้ม
ข้นของ A และ B จะลดลงตามลำา ดับ ในขณะที่ความเข้มข้นของ
C และ D จะเพิ่ ม ขึ้ น ตามลำา ดั บ เนื่ อ งจากมี ภ าวะสมดุ ล เมื่ อ ถึ ง
สมดุลความเข้มข้นของสารแต่ละชนิดจะคงที่
เขียนกราฟระหว่างความเข้มข้นกับเวลาได้ดังนี้
- 17.
t1 คือ ภาวะสมดุลซึ่ง[B] และ [D] ที่เหลือจะมีความเข้ม
ข้นคงที่ กรณีนี้ที่ภาวะสมดุล จะมีความเข้มข้นของ D มากกว่า B
ในกรณีนี้ เวลา t2 จะเป็นเวลาที่ระบบเข้าสู่ภาวะสมดุล ความ
เข้ ม ข้ น ของ B และ D จะคงที่ โ ดยที่ ค วามเข้ ม ข้ น ของ B เหลื อ
มากกว่า D
ถ้าเขียนกราฟระหว่างอัตราการเกิดปฏิกิริยาไปข้างหน้ากั บ
เวลา จะได้ดังนี้
t3 จะเป็ น เวลาที่ ร ะบบอยู่ ใ นภาวะสมดุ ล จะเห็ น ได้ ว่ า ก่ อ น
เวลา t3 อัตราการเกิดปฏิกิริยาจะลดลงจนถึง t3 จะคงที่เพราะอยู่
ในภาวะสมดุล
***********************************************
*************************



![อาจจะวั ด อั ต ราการเกิ ด ปฏิ กิ ริ ย าจากปริ ม าณของ
ตะกอน (ของแข็ง ) ของกำา มะถันที่ เกิ ดขึ้ น หรือ จากความเข้ มข้ น
ของสารละลาย (H+) ทีลดลง
่
การใช้สัญลักษณ์แทนอัตราการเกิดปฏิกิริยาเคมี
พิจารณาปฏิกิริยา
Mg(s) + H2SO4 (aq) → MgSO4 (aq) + H2 (g)
สามารถจะวัดอัตราการเกิดปฏิกิริยาได้ทั้งจากปริมาณ Mg
หรื อ H2SO4 ที่ ล ดลง และจากปริ ม าณของ MgSO4 หรื อ H2 ที่
เกิดขึ้น ซึ่งอาจจะเขียนสัญลักษณ์แทนอัตราการเกิดปฏิกิริยาจาก
สารต่างๆ ได้ดังนี้
ให้ [ ] แทนความเข้มข้น หรือปริมาตรของสาร
∆ แทนการเปลี่ยนแปลง
t แทนระยะเวลาที่เกิดปฏิกิริยา
เครื่องหมาย + แทนการเพิ่มขึ้น
- แทนการลดลง
ถ้าอัตราการเกิดปฏิกิริยาจากความเข้มข้นของกรด H2SO4 ที่
ลดลง
เมื่อเวลาเริ่มต้น (t1) มี H2SO4 เข้มข้น C1
เมื่อเวลา t2 มี H2SO4 เข้มข้น C2
เวลาทีใช้ =่ t2 - t1 = ∆ t
ความเข้มข้นที่ลดลง = C2 - C1 = - ∆ [H2SO4]
อั ต ร า ก า ร ล ด ล ง ข อ ง ก ร ด H2SO4 =
ปริมาณของผ ณฑ์ที ่
ลิตภั ลดลง
เวลา
∆[ H 2 SO 2 ]
∴ อั ต ร า ก า ร ล ด ล ง ข อ ง ก ร ด H2SO4 = −
∆t
………………………… (1)
ใ น ทำา น อ ง เ ดี ย ว กั น ส า ร อื่ น ๆ ก็ ส า ม า ร ถ ห า อั ต ร า ก า ร
เปลียนแปลงได้เช่นเดียวกัน
่
∆[ Mg]
อัตราการลดลงของ Mg = −
∆t
……………………… (2)
∆[ MgSO 4 ]
อัตราการเพิ่มขึ้นของ MgSO4 = +
∆t
………………………… (3)](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-4-320.jpg)
![∆[H 2 ]
อัตราการเพิ่มขึ้นของ H2 = +
∆t
……………………… (4)
อัตราการเปลี่ยนแปลงปริมาณของสารตั้งต้นสมการ (1) -
(4) ยังไม่ใช่อัตราการเกิดปฏิกิริยาเป็นเพียงอัตราการ
เปลียนแปลงปริมาณของสารเท่านั้น แต่สามารถสร้างความ
่
สัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยากับอัตราการเปลี่ยนแปลง
ปริมาณของสารได้
พิจารณาจากสมการ Mg + H2SO4 → MgSO4 + H2
จะเห็นได้ว่า Mg ลดลง 1 โมล H2SO4 จะลดลง 1 โม
ลด้วย พร้อมกันนั้น MgSO4 และ H2 ก็จะเกิดขึ้นอย่างละ 1 โมล
ดังนั้นในเวลา 1 หน่วยเวลา การเปลียนแปลงปริมาณของ Mg,
่
H2SO4 , MgSO4 และ H2 จะเท่ากัน
เช่น ถ้าในเวลา 10 นาที ใช้ Mg ไป 0.1 โมล
0.1
อัตราการลดลงของ Mg = 10
= 0.01 โมล/นาที
อัตราการเปลี่ยนแปลงของ H2SO4 ,MgSO4 ,และ H2 ก็จะ
เป็น 0.01 โมล/นาที เช่นเดียวกัน
เนื่องจากอัตราการเปลี่ยนแปลงของสารทุกตัวต่อ 1 หน่วย
เวลามีค่าเท่ากัน ดังนั้นอัตราการเกิดปฏิกิริยาจึงสามารถพิจารณา
จากการเปลี่ยนแปลงของสารใดก็ได้ และในกรณีนี้อัตราการเกิด
ปฏิกิริยาจึงเท่ากับอัตราการเปลียนแปลงของสาร
่
อัตราการเกิดปฏิกิริยา = อัตราการลดลงของ H2SO4 =
∆[ H 2 SO 2 ]
−
∆t
= อัตราการลดลงของ Mg =
∆[ Mg]
−
∆t
= อัตราการเพิ่มขึ้นของ MgSO4 =
∆[ MgSO 4 ]
+
∆t
= อัตราการเพิ่มขึ้นของ H2 =
∆[H 2 ]
+
∆t
ถ้าให้ R = อัตราการเกิดปฏิกิริยา
∆[ H 2 SO 2 ] ∆[ Mg] ∆[ MgSO 4 ]
R = −
∆t
= −
∆t
= +
∆t
=
∆[H 2 ]
+
∆t](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-5-320.jpg)
![ในกรณีที่ปฏิกิริยาเคมีนั้นเกี่ยวข้องกับสารมากกว่า 1 โมล
อัตราการเกิดปฏิกิริยาจะไม่เท่ากับอัตราการเปลี่ยนแปลงของสาร
นั้น จะต้องมีการเพิ่มแฟกเตอร์บางอย่างเข้าไปจึงจะหาอัตราการ
เกิดปฏิกิริยาได้
พิจารณาตัวอย่างของปฏิกิริยา
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2
(g)
∆[ Mg]
อัตราการลดลงของ Mg = −
∆t
………(1)
∆[ HCl]
อัตราการลดลงของ HCl = −
∆t
……….(2)
∆[ MgCl]
อัตราการเพิ่มขึ้นของ MgSO4 = +
∆t
..…….. (3)
∆[ H 2 ]
อัตราการเพิ่มขึ้นของ H2 = +
∆t
………(4)
อัตราการเปลี่ยนแปลงปริมาณของสารทั้ง 4 ชนิดจะไม่เท่า
กัน
จากสมการถ้าใช้ Mg 1 โมล จะต้องใช้ HCl 2 โมล จึงจะได้
MgCl2 และ H2 อย่างละ 1 โมล
สมมติว่าในเวลา 10 นาที ใช้ Mg ไป 0.1 โมล จะหาอัตราการ
เปลียนแปลงของสารต่างๆ ได้ดังนี้
่
จากสมการ ถ้าใช้ Mg 0.1 โมลจะใช้ HCl 0.2 โมล และได้
MgCl2 กับ H2 อย่างละ 0.1 โมล
0.1
อัตราการลดลงของ Mg = 10
= 0.01
โมล/นาที
0.2
อัตราการลดลงของ HCl = 10
= 0.02
โมล/นาที
0.1
อัตราการลดลงของ MgCl2 = 10
= 0.01
โมล/นาที
0.1
อัตราการลดลงของ H2 = 10
= 0.01
โมล/นาที](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-6-320.jpg)
![จะเห็นได้ว่าอัตราการเปลียนแปลงของสารมีค่าไม่เท่ากัน ถ้า
่
อัตราการเกิดปฏิกิริยา คือ อัตราการเปลี่ ยนแปลงของสาร อั ตรา
การเกิดปฏิกิริยาที่คิดจากสารต่างๆ ก็จะมีค่าไม่เท่ากัน ซึ่งเป็นไป
ไม่ได้ ทังนี้เพราะ อัตราการเกิดปฏิกิริยาของปฏิกิริยาเคมีหนึ่งๆ จะ
้
ต้องมีค่าเท่ากันไม่ว่าจะคิดจากสารใด ดังนั้นอัตราการเกิดปฏิกิริยา
จึงไม่ใช่ อัตราการเปลี่ยนแปลงของสาร แต่สามารถคิดจากอัตรา
การเปลี่ยนแปลงของสารได้
การที่จะทำา ให้อัตราการเกิดปฏิกิริยามีค่าเท่ากันไม่ว่าจะคิด
จากสารใด ต้องมีการเพิ่มแฟกเตอร์บางอย่างเข้าไป
พิจารณากรณีของ HCl ถ้าคูณอั ตราการลดของ HCl ด้วย
1/2 จะพบว่าอัตราการเกิดเปลี่ยนแปลงจะเท่ากับสารอี่นๆ
0.2
1/2 x อั ต ราการลดลงของ HCl = 1/2 x 10
=
0.01 โมล/นาที
ตัวเลข “2” ที่เพิ่มเข้าไป ก็คือจำา นวนโมลของ HCl นั่นเอง
ซึ่ ง เ ป็ น แ ฟ ก เ ต อ ร์ ที่ ต้ อ ง เ พิ่ ม เ ข้ า ไ ป เ พื่ อ ทำา ใ ห้ อั ต ร า ก า ร
เปลียนแปลงเท่ากัน
่
อัตราการลดลงของ Mg = 0.01 โมล/
นาที
1/2 x อัตราการลดลงของ HCl = 0.01 โมล/
นาที
อัตราการลดลงของ MgCl2 = 0.01 โมล/
นาที
อัตราการลดลงของ H2 = 0.01 โมล/
นาที
จะเห็นว่าทุกกรณีเท่ากัน
ดังนั้น จึงเขียนอัตราการเกิดปฏิกิริยาเคมีจากสารต่างๆ ได้
ดังนี้
∆[ Mg] 1 ∆[ HCl] ∆[ MgCl] ∆[ H 2 ]
R = −
∆t
= −
2 ∆t
= +
∆t
= +
∆t
อัตราการเกิดปฏิกิริยาเคมีจึงมีส่วนสัมพันธ์กับอัตราการ
เปลียนแปลงของสารผ่านทางแฟกเตอร์เกี่ยวกับจำานวนโมล ซึ่ง
่
เขียนความสัมพันธ์ทวๆ ไป ได้ดังนี้
ั่
1
R = n
x อัตราการเปลียนแปลงของสาร
่
1 ∆[ X]
หรือ R = n
. ∆t](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-7-320.jpg)
![เมื่อ
n = จำานวนโมลของสาร X
[X] = ความเข้มข้นของสาร X
ในกรณีที่พิจารณาสมการทั่วๆ ไป
aA + bB → cC + dD
จะเขียนอัตราการเกิดปฏิกิริยาไดเป็น
1 ∆[ A] 1 ∆[B] 1 ∆[C]
R = −
a ∆t
= −
b ∆t
= +
c ∆t
=
1 ∆[D]
+
d ∆t
ตัวอย่างเช่น
2A + 3B → C + 4D
1 ∆[ A] 1 ∆[ B] ∆[C] 1 ∆[D]
R = −
2 ∆t
= −
3 ∆t
= +
∆t
= +
4 ∆t
นั่นคือ อัตราการเกิดปฏิกิริยาเคมีคิดจากสารใดก็ได้ แต่ต้อง
คิดตามความสัมพันธ์ดังกล่าว
ประเภทของอัตราการเกิดปฏิกิริยา
อัตราการเกิดปฏิกิริยาแบ่งออกเป็น 2 ประเภท
ก. อัตราการเกิดปฏิกิริยาเฉลี่ย หมายถึง อัตราการเกิด
ปฏิกิริยาที่คิดจากการเปลียนแปลงปริมาณของผลิตภัณฑ์ (หรือ
่
สารตั้งต้น) ทังหมดใน 1 หน่วยเวลา
้
ข. อัตราการเกิดปฏิกิริยา ณ ขณะหนึ่ง หมายถึง อัตรา
การเกิดปฏิกิริยา ณ เวลาใดเวลาหนึ่ง ซึ่งคือ ค่าความชัน (slope)
ของกราฟระหว่างปริมาณของสารที่เปลี่ยนแปลงกับเวลา
โดยทัวๆ ไป อัตราการเกิดปฏิกิริยา 2 ประเภทจะไม่เท่ากัน
่
ในปฏิกิริยาทัวๆ ไป ช่วงแรกของการเกิดปฏิกิริยาจะค่อนข้าง
่
เร็วและค่อยๆ ช้าลงตามลำาดับ ทำาให้อัตราการเกิดปฏิกิริยา ณ
ขณะใดขณะหนึ่งมีค่าไม่เท่ากัน
ตัวอย่างที่ 1 จากปฏิกิริยา
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O
+ 5Cl2
จงเขียนอัตราการเกิดปฏิกิริยาในเทอมของสารต่างๆ](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-8-320.jpg)
![วิธีทำา จากสมการทั่วๆ ไปที่กล่าวมาในตอนต้น สามารถเขียน
อัตราการเกิดปฏิกิริยาได้ดังนี้
1 ∆[KMnO 4 ]
อัตราการเกิดปฏิกิริยา = −
2 ∆t
=
1 ∆[ HCl] 1 ∆[ KCl]
−
16 ∆t
= +
2 ∆t
1 ∆[H 2 O] 1 ∆[ MnCl 2 ]
= +
8 ∆t
= +
2 ∆t
=
1 ∆[Cl 2 ]
+
5 ∆t
ตัวอย่างที่ 2 เมื่อสาร A ทำาปฏิกิริยากับสาร B ได้ผลิตภัณฑ์เป็น
สาร C เพี ย งชนิ ด เดี ย วจากการทดลองพบว่ า อั ต ราการเกิ ด
ปฏิกิริยา ถ้าคิดจากสาร A จะเท่ากับ 1/2 เท่าของอัตราการลด
ลงของสาร A ถ้าคิดจากสาร B จะเท่ากับ 2 เท่าของอัตราการ
ลดลงของสาร B และถ้าคิดจากสาร C จะเท่ากับ 1/3 เท่าของ
อัตราการเพิ่มขึ้นของสาร C สมการที่ใช้แสดงปฏิกิริยานี้คืออะไร
?
1 ∆[A ]
วิธีทำา จากโจทย์ อั ต ราการเกิ ด ปฏิ กิ ริ ย า = −
2 ∆t
=
2 ∆[B] 1 ∆[C]
−
1 ∆t
= +
3 ∆t
เลขที่อยู่ขางหน้าอัตราการเปลียนแปลงของสารเกี่ยวข้อง
้ ่
1 ∆[ A]
กับจำานวนโมลของสารนั้น ๆ ใน สมการ เช่น −
2 ∆t
แสดงว่า
ในสมการจะมี A 2 โมล
∴ เขียนเป็นสมการได้ดังนี้
2A + 1/2 B → 3C
หรือ 4A + B → 6C
ตัวอย่างที่ 3 เมื่อนำาก๊าซ N2O5 ไปละลายในตัวทำาละลายอินทรีย์
ชนิดหนึ่ง N2O5 จะสลายตัวดังสมการ
2N2O5 (g) → 4NO2 (g) + O2 (g)
ถ้ า NO2 ละลายในตั ว ทำา ละลายอิ น ทรี ย์ นั้ น และ O2 ไม่
ละลาย วิธีการวัดอัตราการเกิดปฏิกิริยาต่อไปนี้ วิธีใดบ้างใช้ได้
ก. วัดปริมาตรของก๊าซ O2 ทีเกิดขึ้น ค. วัดการนำา ไฟฟ้า
่
ของสารละลาย
ข. วัดความดันของก๊าซ O2 ที่เกิดขึ้น ง . วั ด ม ว ล ข อ ง
สารละลายที่ลดลง](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-9-320.jpg)

![0.75
∴ อัตราการเกิด H2 = = 0.075 โมล/
10
นาที
0.75
และอั ต ราการลดลงของ H2SO4 = 10
= 0.075
โมล/นาที
ข. คำานวณอัตราการเกิดปฏิกิริยา
1 ∆[H 2SO 4 ] 1
อั ต ราการเกิ ด ปฏิ กิ ริ ย า = −
3 ∆t
= 3
x
0.075 = 0.025 โมล/ลิตร
หมายเหตุ อาจจะคิดอัตราการเกิดปฏิกิริยาจากสารตัวอื่น
ก็ได้ จะได้คำาตอบเท่ากัน
ตัว อย่ างที่ 5 จากการทดลองหาอัตราการเกิ ดปฏิกิริย าระหว่าง
Mg กับ HCl ตามสมการ
Mg + 2HCl → MgCl2 + H2
โดยการเก็บก๊าซ H2 จากการแทนที่สารละลายดังในรูป
ผลการทดลองได้ดังนี้
ปริมาตร H2 เวลา ปริมาตร H2 เวลา (s)
(cm )3
(s) (cm3)
1 7 4 32
2 15 6 60
3 23 8 105
ก. จงคำานวณอัตราเฉลี่ยของการเกิดก๊าซ H2
ข. จงคำา นวณอัตราการเกิดก๊าซ H2 ระหว่างเวลา 23 - 32
วินาที
ค. จงคำานวณอัตราการเกิดก๊าซ H2 ณ วินาทีที่ 50
วิธทำาก. คำานวณอัตราเฉลี่ย
ี](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-11-320.jpg)



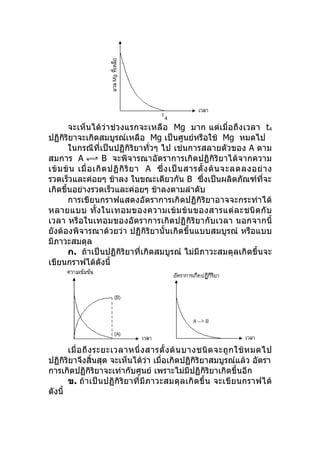

![t1 คือ ภาวะสมดุลซึ่ง [B] และ [D] ที่เหลือจะมีความเข้ม
ข้นคงที่ กรณีนี้ที่ภาวะสมดุล จะมีความเข้มข้นของ D มากกว่า B
ในกรณีนี้ เวลา t2 จะเป็นเวลาที่ระบบเข้าสู่ภาวะสมดุล ความ
เข้ ม ข้ น ของ B และ D จะคงที่ โ ดยที่ ค วามเข้ ม ข้ น ของ B เหลื อ
มากกว่า D
ถ้าเขียนกราฟระหว่างอัตราการเกิดปฏิกิริยาไปข้างหน้ากั บ
เวลา จะได้ดังนี้
t3 จะเป็ น เวลาที่ ร ะบบอยู่ ใ นภาวะสมดุ ล จะเห็ น ได้ ว่ า ก่ อ น
เวลา t3 อัตราการเกิดปฏิกิริยาจะลดลงจนถึง t3 จะคงที่เพราะอยู่
ในภาวะสมดุล
***********************************************
*************************](https://image.slidesharecdn.com/12-101001015203-phpapp02/85/1-2-17-320.jpg)