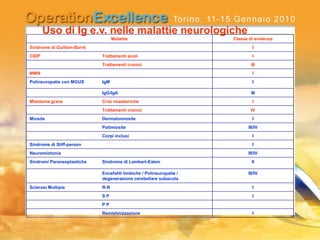
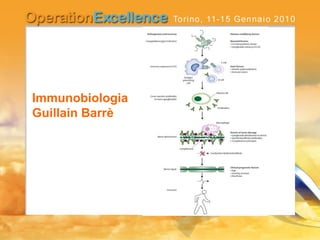
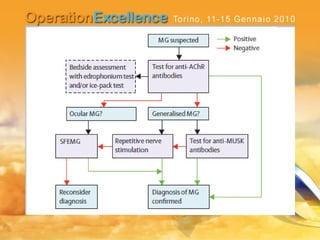
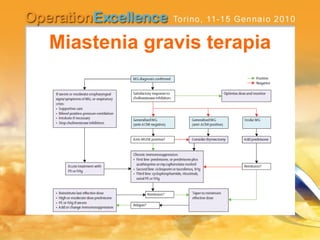
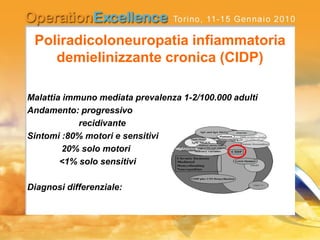
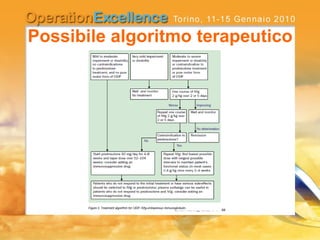
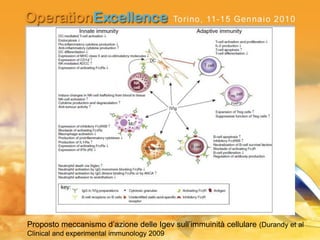
Il documento analizza le neuropatie periferiche come la sindrome di Guillain-Barré, la neuropatia multifocale motoria e la miastenia gravis, con focus su meccanismi immunologici e approcci terapeutici. Descrive la patofisiologia, le diagnosi, la terapia con immunoglobuline e i risultati clinici, evidenziando l'importanza del trattamento precoce e la variabilità nella risposta terapeutica. Viene inoltre discusso l'impatto delle immunoglobuline endovena sulle cellule T e B e i loro meccanismi d'azione.