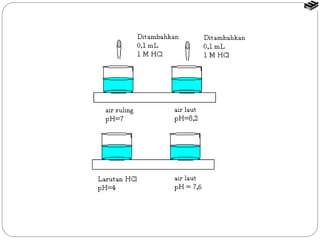
Larutan penyangga mengandung asam atau basa lemah dan konjugasinya. Ia dapat menetralkan asam atau basa yang ditambahkan dengan mereaksikan keduanya, sehingga pH larutan tetap stabil. Sistem penyangga utama dalam tubuh adalah fosfat dan bikarbonat yang menjaga pH darah konstan sekitar 7,4.