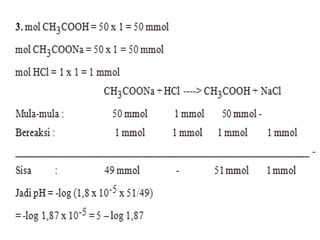
Dokumen ini menjelaskan tentang larutan penyangga, termasuk definisi, jenis, dan contoh-contoh larutan penyangga asam dan basa. Selain itu, dokumen juga membahas fungsi larutan penyangga dalam kehidupan sehari-hari seperti pengendalian pH darah, peran air liur, keseimbangan pH tanaman, dan aplikasi dalam obat-obatan. Contoh soal mengenai perhitungan pH larutan penyangga juga disediakan untuk memperjelas konsep tersebut.




![Nilai pH Larutan Penyangga
Larutan Asam
mol asam
[H+] = Ka x
mol basa konjugasi
Larutan Basa
mol basa
[OH-] = Kb x
mol asam konjugasi](https://image.slidesharecdn.com/larutanpenyangga-160117092525/85/Larutan-penyangga-5-320.jpg)

![Jawaban :
1. mol CH₃COOH = 800 x 0,1
= 80 mmol
mol CH₃COONa = 400 x 0,1
= 40 mmol
[H⁺] = Ka .na/nbk
= 1,8 x 10⁻⁵x( 80/40)
= 3,6 x 10 ⁻⁵
pH = -log 3,6 x 10 ⁻⁵
= 5 – log 3,2](https://image.slidesharecdn.com/larutanpenyangga-160117092525/85/Larutan-penyangga-7-320.jpg)
![2. mol NH3 = 400 x 0,5 = 200 mmol
mol NH4Cl = 100 x 0,5 = 50 mmol
[OH⁻] = 1,8 x10⁻⁵x(200/50)
= 7,2 x 10⁻⁵
pOH = - log 7,2 x 10⁻⁵
= 5 – log 7,2
pH = 14 – (5-log 7,2)
= 9 + log 7,2](https://image.slidesharecdn.com/larutanpenyangga-160117092525/85/Larutan-penyangga-8-320.jpg)