Dokumen ini menjelaskan tentang larutan penyangga (buffer) yang mampu mempertahankan nilai pH tertentu, baik dalam bentuk asam maupun basa. Contoh penerapan larutan penyangga dapat ditemukan di air laut, darah, dan biokimia, serta cara kerjanya dalam reaksi kimia yang melibatkan penambahan asam atau basa. Selain itu, dokumen juga mencakup contoh perhitungan pH larutan penyangga dan sistem buffer dalam tubuh manusia.










![MENGHITUNG PH LARUTAN PENYANGGA
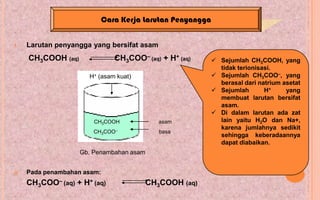
Larutan Penyangga Asam
[H+ ] = Ka x [asam lemah]
[basa konjugasi]
= Ka x mol asam lemah
mol basa konjugasi
pH = pKa – log
[ mol asam lemah
mol basa konjugasi ]](https://image.slidesharecdn.com/chandraxiiipa1larutanpenyangga-121016005050-phpapp01/85/Larutan-Penyangga-13-320.jpg)
![MENGHITUNG PH LARUTAN PENYANGGA
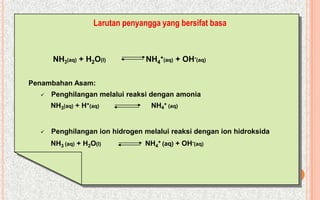
Larutan penyangga basa
[basa lemah]
[OH-] = Kb x [asam konjugasi]
= Kb x mol basa lemah
mol asam konjugasi
pOH = pKb – log [ mol basa lemah
mol asam konjugasi ]
pH = 14 – pOH](https://image.slidesharecdn.com/chandraxiiipa1larutanpenyangga-121016005050-phpapp01/85/Larutan-Penyangga-14-320.jpg)
![CONTOH SOAL 1
1. Hitunglah pH larutan yang terdiri atas campuran 0,01 mol asam
asetat dengan 0,1 mol natrium asetat dalam 1 liter larutan !
(Ka asam asetat = 1,8 x 10–5)
Jawab :
Mol CH3COOH = 0,01 mol
Mol CH3COO- = 0,10 mol
pH = pKa – log [CH3COOH / CH3COO- ]
= - log (1,8 x 10–5) – log (0,01/0,1) = 4,74 + 1 = 5,74](https://image.slidesharecdn.com/chandraxiiipa1larutanpenyangga-121016005050-phpapp01/85/Larutan-Penyangga-15-320.jpg)


![Jawaban Soal Latihan
b. Berapa pH larutan setelah
a. Tentukan pH larutannya. ditambahkan 1 ML HCl 0,1 M?
[OH-] = Kb x (100 x 0,1/100 x 0,1 = 10–5 Mol HCl = 1 mL x 0,1 mmol/mL = 0,1 mmol
pOH = 5 pH = 14 – 5 = 9 NH3 + H+ NH4+
Awal : 10 mmol 0,1 mmol 10 mmol
Reaksi : -0,1 mmol -0,1 mmol +0,1mmol
Akhir : 9,9 mmol 0 10,1 mmol
[OH-] = 10–5 x 9,9/10,1 = 0,98 x 10–5
pOH = 5,00877 pH = 8,99](https://image.slidesharecdn.com/chandraxiiipa1larutanpenyangga-121016005050-phpapp01/85/Larutan-Penyangga-18-320.jpg)
![Jawaban Soal Latihan
C. Jika ditambah 1 mL NaOH 0,1 M, berapakah pH-
nya?
Mol NaOH = 1 mL x 0,1 mmol/mL = 0,1 mmol
NH4+ + OH - NH3 + H2O
Awal : 10 mmol 0,1 mmol 10 mmol
Reaksi : -0,1 mmol -0,1 mmol +0,1mmol
Akhir : 9,9 mmol 0 10,1 mmol
[OH-] = 10–5 x 10,1/9,9 = 1,0202 x 10–5
pOH = 4,99 pH = 9,01](https://image.slidesharecdn.com/chandraxiiipa1larutanpenyangga-121016005050-phpapp01/85/Larutan-Penyangga-19-320.jpg)









