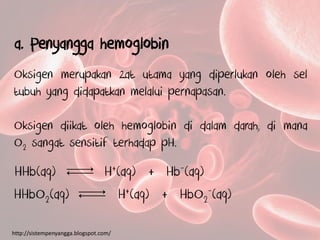
Dokumen tersebut membahas tentang larutan penyangga dan fungsinya dalam tubuh makhluk hidup. Larutan penyangga dapat mempertahankan pH terhadap penambahan asam atau basa. Larutan penyangga dalam tubuh terdiri dari hemoglobin, karbonat, dan fosfat yang bekerja bersama-sama untuk menjaga pH darah tetap stabil antara 7,35-7,45.