Larutan penyangga mampu mempertahankan pHnya meski ditambah asam atau basa karena mengandung campuran asam/basa lemah dan konjugasinya. Larutan ini dibuat dengan mencampur asam lemah dan basa konjugasinya atau sebaliknya, dan bermanfaat untuk menjaga pH darah, cairan tubuh, makanan, dan produk seperti obat dan fotografi.









![][
]][[
3
3
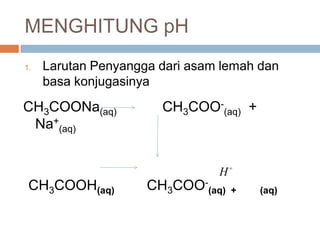
COOHCH
HCOOCH
Ka
ltrmolCOOCH
ltrmolCOOHCH
KaH
/][
/][
.][
3
3
Berasal dari garam](https://image.slidesharecdn.com/larutanpenyangga-130501062219-phpapp01/85/Larutan-penyangga-12-320.jpg)
![][
][
.][
ng
na
KaH
Untuk basa konjugasi yang memiliki 2 anion maka :
]2[
][
.][
ng
na
KaH](https://image.slidesharecdn.com/larutanpenyangga-130501062219-phpapp01/85/Larutan-penyangga-13-320.jpg)
![][
]][[
4
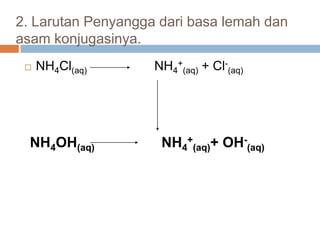
4
OHNH
OHNH
Kb
ltrmolNH
ltrmolOHNH
KbOH
/][
/][
.][
4
4
Berasal dari garam](https://image.slidesharecdn.com/larutanpenyangga-130501062219-phpapp01/85/Larutan-penyangga-15-320.jpg)
![][
][
.][
ng
nb
KbOH
]2[
][
.][
ng
nb
KbOH
Untuk basa konjugasi yang memiliki 2 anion maka :](https://image.slidesharecdn.com/larutanpenyangga-130501062219-phpapp01/85/Larutan-penyangga-16-320.jpg)



