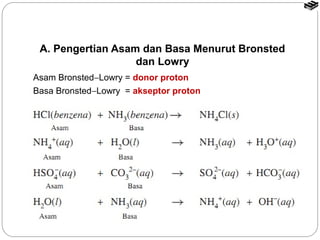
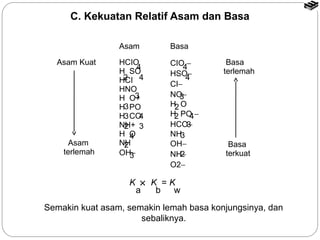
Bab 5 membahas larutan asam dan basa, termasuk konsep asam dan basa menurut teori Arrhenius, Brønsted-Lowry, dan Lewis. Terdapat penjelasan tentang sifat larutan asam dan basa, pengukuran pH, derajat ionisasi, tetapan ionisasi, dan reaksi antara asam dan basa.





![C. Konsep pH, pOH, dan pKw
pH = -log [OH+]
Tetapan kesetimbangan air (Kw )
Kw = [H+] ´ [OH-]
Dalam air murni
pH + pOH = pKw
pOH = -log [OH-]](https://image.slidesharecdn.com/bab5laru-141128070301-conversion-gate01/85/Bab5-laru-6-320.jpg)

![2. Tetapan Ionisasi Asam (K )
a
Tetapan kesetimbangan untuk ionisasi asam disebut tetapan ionisasi asam dan
diberi lambang K .
K
a
Reaksi ionisasi asam lemah valensi satu
3. Hubungan (K ) dengan (a)
a = M
a
HA(aq) H+ (aq) + A-(aq)
K =
[H+][A-]
a [HA]
a](https://image.slidesharecdn.com/bab5laru-141128070301-conversion-gate01/85/Bab5-laru-8-320.jpg)
![Reaksi ionisasi basa lemah bervalensi satu
LOH(aq) L+(aq) + OH-(aq)
Tetapan kesetimbangan persamaaan untuk ionisasi basa disebut tetapan
ionisasi basa (K ).
[L+] ´ [OH -]
[LOH]
K =
b
Hubungan tetapan ionisasi basa dengan derajat ionisasi basa adalah sebagai
berikut.
K
b
a = M
b
E. Kekuatan Asam](https://image.slidesharecdn.com/bab5laru-141128070301-conversion-gate01/85/Bab5-laru-9-320.jpg)
![F. Menghitung pH Larutan Asam-Basa
1. Asam Kuat
[H+] = M ´ valensi asam
contoh
Berapakah pH dari larutan HCl 0,01M](https://image.slidesharecdn.com/bab5laru-141128070301-conversion-gate01/85/Bab5-laru-10-320.jpg)