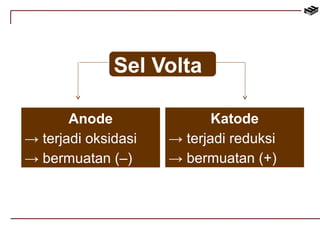
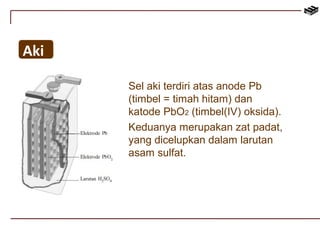
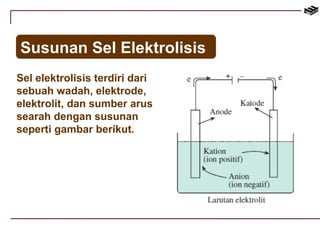
Dokumen tersebut membahas tentang reaksi redoks dan elektrokimia, termasuk penyetaraan reaksi redoks, sel volta, elektrolisis, dan korosi. Secara khusus membahas metode penyetaraan reaksi redoks, susunan sel volta, potensial elektrode standar, dan hukum-hukum Faraday yang terkait dengan elektrolisis.