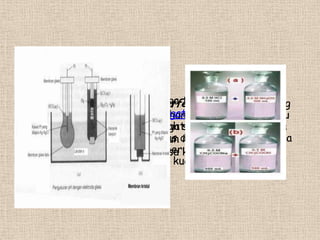
Larutan penyangga terdiri dari asam lemah dan basa konjugasinya. Ia dapat mengikat baik ion H+ maupun OH- sehingga pH larutan hanya berubah sedikit saat ditambahkan asam atau basa. Larutan penyangga penting untuk menjaga pH darah, cairan sel, dan media hidroponik. Contohnya adalah penyangga karbonat dalam darah dan penyangga fosfat di dalam sel.





![pH BASA
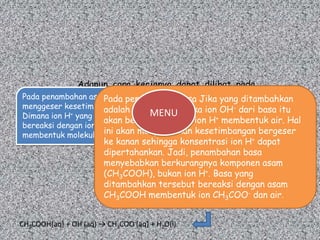
Dapat digunakan tetapan ionisasi
dalam menentukan konsentrasi ion
Dapat digunakansuatu larutan dengan
H+ dalam tetapan ionisasi [H+] = Ka x a/g
rumus berikut:
dalam menentukan konsentrasi ion atau
H+ dalam suatu larutan dengan pH = p Ka - log a/g
rumus berikut: pH ASAM pH BASA
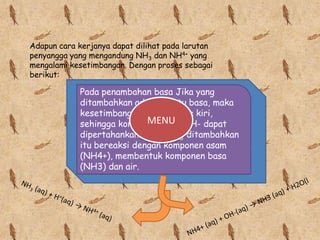
MENU [OH-] = Kb x b/g
atau
pH = p Kb - log b/g
Ka = tetapan ionisasi asam lemah
a = jumlah mol asam lemah
Kb = tetapan ionisasi basa = jumlah mol basa
g lemah
b = jumlah mol basa lemah
konjugas
g = jumlah mol asam
konjugasi](https://image.slidesharecdn.com/larutanbuffer-111216181518-phpapp01/85/Larutan-buffer-9-320.jpg)


