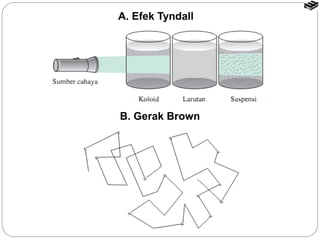
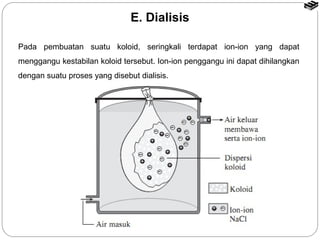
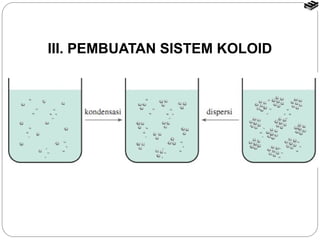
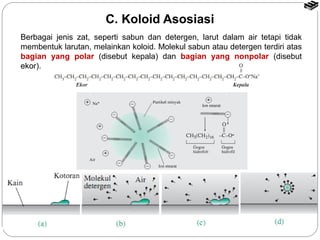
Dokumen tersebut membahas tentang sistem koloid, termasuk definisi, jenis, sifat, dan cara pembuatan koloid. Koloid adalah sistem heterogen dimana zat terdispersi berukuran 1 nm hingga 100 nm dan tercampur secara homogen di dalam medium dispersi. Terdapat beberapa jenis koloid seperti sol, emulsi, buih, dan gel yang berbeda berdasarkan fase terdispersi dan medium dispersinya. Sifat koloid meliputi efek Tyndall, gerak Brown,