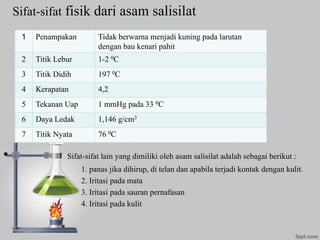
1. Dokumen berisi daftar nama anggota kelompok 4 dan reaksi identifikasi kation golongan I, II, dan III seperti timbal, merkurium, perak, tembaga, arsenik, stibium, dan timah.
2. Kation-kation tersebut dapat diidentifikasi melalui reaksi dengan hidrogen sulfida, larutan amonia, natrium hidroksida, kalium iodida, dan logam lain seperti zink, timah, dan besi.
3. Reaksi-




![3. Identifikasi Perak (Ag+)
a. Dengan asam klorida encer atau klorida –klorida yang larut terbentuk endapan perak klorida.Endapan larut
dalam amonia encer dan dengan asam nitrat encer akan menetralkan kelebihan amonia sehingga akan
terbentuk endapan lagi.
Ag+ + 2Cl- → AgCl↓
Ag+ + 2NH3
-→ [Ag (NH3)2]++ Cl-
b. Dengan hidrogen sulfida dalam suasana netral atau asam encer terbentuk endapan hitam perak sulfida .
2Ag+ + H2S ↔ Ag2S↓ + 2H+
c. Dengan larutan amonia terbentuk endapan coklat perak oksida.
2Ag+ + 2NH3 + H2O → Ag2O↓ + 2NH4
+
d. Dengan larutan NaOH terbentuk endapan coklat perak oksida
2Ag+ + 2OH- → Ag2O↓ + H2O
e. Dengan Kalium Iodida terbentuk endapan kuning perak iodida, jika
ditambah reagensia amonia encer/pekat endapan tidak larut. Endapan
mudah larut dalam kalium sianida dan natrium tiosulfat.
Ag+ + I- → AgI ↓
AgI ↓+ 2CN-→ [Ag(CN)2]- + I -
AgI ↓+ 2S2O3
2 -→ Ag(S2O3)2
3- + I –](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-5-320.jpg)
![A. Identifikasi Kation Golongan II
1. Identifikasi Merkurium (II)
a. Dengan Hidrogen sulfida (gas/larutan jenuh): dengan adanya asam klorida encer, mulamula akan
terbentuk endapan putih merkurium (II) klorosulfida yang terurai bila ditambahkan hydrogen
sulfida lebih lanjut dan akhirnya terbentuk endapan hitam merkuri (II) sulfida.
3Hg2+ + 2Cl- + 2H2S ↔Hg3S2Cl2↓ + 4H+ + 2Cl-
b. Dengan larutan amonia terbentuk endapan putih yang merupakan campuran merkurium (II) oksida
dan merkurium (II) amidonitrat.
2Hg2+ + NO3
- + 4NH3 +H2O → HgO Hg ( NH2)NO3↓ + 2Hg↓ + 3NH4
+
c. Dengan larutan NaOH dalam jumlah sedikit terbentuk endapan merah kecoklatan, bila
ditambahkan dalam jumlah yang stoikiometris endapan berubah menjadi kuning terbentuk
Merkurium (II) oksida Hg2+ + 2OH- →HgO↓ + H2O
d. Dengan Kalium Iodida bila ditambahkan perlahan-lahan pada larutan
terbentuk endapan merah merkurium(II) iodida, jika ditambah reagensia
berlebihan terbentuk ion tetraiodomerkurat (II) yang larut
Hg2+ + 2I -→HgI2 ↓
HgI2 ↓ + 2I- -→[HgI4]2- ↓
e. Dengan kalium sianida tidak terjadi perubahan apa-apa.](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-6-320.jpg)





























![d. Dengan larutan besi (III) klorida terbentuk larutan merah darah karena terbentuknya
suatu kompleks.
SCN-+ Fe3+ → Fe( SCN)3↓
H. Identifikasi Ion Ferrosianida = [Fe(CN)6]4
a. Dengan larutan Argentum nitrat terbentuk endapan putih, endapan tidak larut dalam amonia tapilarut
dalam kalium sianida dan natrium tiosulfat.
[Fe(CN)6]4-+ 4Ag+ → Ag4 [Fe(CN)6]↓
Ag4 [Fe(CN)6]↓ + 8CN-→ 4 [Ag(CN)2]-+ [Fe(CN)6]4-
Ag4 [Fe(CN)6]↓ + 8S2O32-→ 4 [Ag(S2O3)2]3-+ [Fe(CN)6]4-
b. Dengan larutan Ferri klorida terbentuk endapan biru prussian.
3[Fe(CN)6]4-+ Fe3+→ Fe4[Fe(CN)6]3↓
c. Dengan larutan Ferro sulfat terbentuk endapan putih yang dengan cepat
menjadi biru karena oksidasi.
[Fe(CN)6]4- + Fe2+ + 2K+→ K2Fe[Fe(CN)6]↓
d. Dengan larutan Cupri sulfat terbentuk endapan coklat
[Fe(CN)6]4-+ 2Cu2+→ Cu2[Fe(CN)6]↓](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-36-320.jpg)
![I. Identifikasi ion Ferrisianida = [Fe(CN)6]3-
a. Dengan larutan Argentum nitrat terbentuk endapan merah jingga
[Fe(CN)6]3-+ 3Ag+→ Ag3 [Fe(CN)6]↓
b. Dengan larutan Ferro sulfat terbentuk endapan biru Turnbull
[Fe(CN)6]3- + Fe2+→ Fe3[Fe(CN)6]2
c. Dengan larutan Ferri klorida terbentuk larutan coklat
[Fe(CN)6]3- + Fe3+→ Fe[Fe(CN)6]
d. Dengan larutan Cupri sulfat terbentuk endapan hijau
[Fe(CN)6]3-+ 3Cu2+→ Cu3[Fe(CN)6]2 ↓
J. Identifikasi ion Klorida (Cl )
a. Dengan larutan Argentum nitrat terbentuk endapan putih yang larut dalam larutan amonia
encer dan dengan larutan asam nitrat encer akan terbentuk endapan putih lagi. Endapan dikenakan sinar
matahari menjadi endapan ungu.
Cl-+ Ag+ → AgCl↓
AgCl↓ + 2NH3→ [Ag (NH3)2]+ + Cl-
[Ag (NH3)2]+ + Cl- + 2H+ → AgCl↓ + 2NH4+](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-37-320.jpg)
![b. Dengan larutan Asam sulfat pekat, dipanaskan timbul gas. Gas ini dapat dibuktikan dengan:
1. Bau yang merangsang
2. Membentuk kabut putih, jika batang pengaduk yang dibasahi dengan ammonium hidroksida
pekat didekatkan ke mulut tabung reaksi
3. Kertas lakmus biru merah
Cl- + H2SO4 → HCl↑ + HSO4-
c. Dengan larutan Plumbum nitrat terbentuk endapan putih, bila dipanaskan endapan larut dan
bila didinginkan terbentuk endapan jarum
2Cl-+ Pb2+ → PbCl2↓
K. Identifikasi ion Bromida ( Br-)
a. Dengan larutan Argentum nitrat terbentuk endapan kuning muda.
Br- + Ag+ → AgBr↓
AgBr↓ + 2NH3 → [Ag (NH3)2]+ + Br-
AgBr↓ + 2CN-→ [Ag(CN)2]- + Br-
AgBr↓+2S2O32-→ [Ag(S2O3)2]3- + Br-
b. Dengan larutan Asam nitrat pekat, dipanaskan terbentuk larutan coklat
merah, timbul uap coklat merah, dibuktikan dengan:
1. Larutan + kloroform lapisan kloroform berwarna coklat merah
2. Kertas saring yang dibasahi dengan fluorescein, akan berwarna merah
jingga jika diletakkan di mulut tabung reaksi
6Br- + 8HNO3→ 3Br2↑ + 2NO↑ + 6NO3- + 4H2O](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-38-320.jpg)
![c. Dengan larutan Plumbum nitrat terbentuk endapan putih, yang larut di air mendidih
2Br + Pb2+→ PbBr 2
L. Identifikasi ion Iodida ( I )
a. Dengan larutan Argentum nitrat terbentuk endapan kuning yang mudah larut dalam larutan
kalium sianida dan larutan natrium tiosulfat.
I-+ Ag+ → AgI↓
AgI↓ + 2CN-→ [Ag (CN)2]- + I-
AgI↓ + 2S2O32-→ [Ag(S2O3)2]3-+ I-
b. Dengan larutan asam sulfat pekat terbentuk timbul uap ungu, dibuktikan dengan:
1. Larutan + kloroform terbentuk lapisan kloroform berwarna ungu
2. Kertas saring yang dibasahi amylum, akan berwarna biru jika diletakkan di atas tabung
reaksi
2I- + 2H2SO4 → I2↑+ SO42-+ 2H2O
I- + H2SO4 → HI↑+ HSO4-
6I- + 4H2SO4 →3I2↑+ S↓ + 3SO42-+ 4H2O
8I- + 5H2SO4 → 4I2↑+ H2S + 4SO4 2-+ 4H2O
c. Dengan larutan Plumbum nitrat terbentuk endapan kuning yang bila
diencerkan dengan aquadest terbentuk endapan larut dan bila
didinginkan terbentuk endapan berbentuk keping-keping kuning
emas seperti sisik ikan.
2I-+ Pb2+ → PbI2↓](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-39-320.jpg)
![d. Dengan larutan sampel ditambah Merkuri klorida terbentuk endapan merah jingga, jika
sampel berlebih terbentuk endapan larut.
2I-+ HgCl2 → HgI2↓ +2Cl-
M. Identifikasi ion Borat ( BO33-, B4O72-, BO2-)
a. Dengan larutan Argentum nitrat terbentuk endapan putih, bila terhidrolisis menjadi endapan
menjadi coklat.
B4O7 2-+ 4Ag+ + H20→ 4AgBO2↓ + 2H+
2AgBO2↓+3 H20→ Ag2O↓ + 3H3BO3
b. Dengan larutan diuapkan di atas cawan porselin, setelah kering ditambah metanol, kemudian
dibakar terbentuk nyala api hijau.
c. Dengan larutan Barium klorida terbentuk endapan putih, bila ditambah larutan Barium klorida
berlebih terbentuk endapan larut
B4O72-+ 2Ba2++ H2O → 2Ba(BO2)2↓ + 2H+
N. Identifikasi ion Kromat atau Dikromat (CrO42atau Cr 2O72-)
a. Dengan larutan Argentum nitrat terbentuk endapan merah coklat,
endapan larut dalam asam nitrat encer dan dalam larutan amonia. Asam
klorida mengubah endapan menjadi perak klorida (putih).
CrO2-+ 2Ag+ → Ag2 CrO4↓
2Ag2 CrO4↓ + 2H+→ 4Ag+ + Cr 2O72- + H20
Ag2 CrO4↓ + 4NH3 → 2[Ag (NH3)2]+ + CrO42-
Ag2 CrO4↓+2Cl-→ 2AgCl↓ + CrO42-](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-40-320.jpg)

![e. Dengan larutan asam sulfat encer ditambah Ferro sulfat warna ungu dilunturkan
2MnO4- + 5Fe2+ + 8H+ → 5Fe3+ + Mn2+ + 4H2O
f. Dengan larutan asam sulfat encer ditambah asam oksalat warna ungu dilunturkan
2MnO4- + 5 (COO)22- + 16H+ →10CO2↑ + 2Mn2+ + 8H2O
P. Identifikasi ion Asetat ( CH3COO )
a. Dengan larutan Argentum nitrat terbentuk endapan putih
CH3COO-+ Ag+ ↔ CH3COOAg
b. Dengan larutan Alkohol dan asam sulfat pekat terbentuk bau harum
CH3COO-+ C2H5OH → CH3COOC2H5 + OH-
c. Dengan larutan Ferri klorida terbentuk larutan coklat merah
6CH3COO- + 3Fe3+ + 2H2O→ [Fe3(OH)2( CH3COO-)6]+ + 2H+
[Fe3(OH)2( CH3COO-)6]+ + 4H2O→ 3Fe(OH)2 CH3COO↓ + CH3COOH + H+](https://image.slidesharecdn.com/kelompok4-converted-200728153026/85/PPT-Identifikasi-Anion-dan-Kation-42-320.jpg)