REAKSI HALOGEN
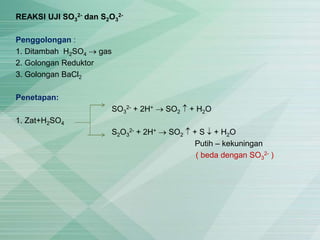
- 1. REAKSI UJI SO3 2- dan S2O3 2- Penggolongan : 1. Ditambah H2SO4 gas 2. Golongan Reduktor 3. Golongan BaCl2 Penetapan: SO3 2- + 2H+ SO2 + H2O 1. Zat+H2SO4 S2O3 2- + 2H+ SO2 + S + H2O Putih – kekuningan ( beda dengan SO3 2- )
- 2. 2. Uji gas SO2 yang dihasilkan dari reaksi 1 3SO2 + K2Cr2O7 + H+ 2 Cr3+ + 3SO4 2- + H2O jingga hijau atau 5SO2 + 2SO3 2- + H2O S2 + 5SO4 2- + 8H+ 3. Larutan zat + I2 SO3 2- + H2O + I2 SO4 2- + HI coklat t.b 2S2O3 2- + I2 S4O6 2- + 2I- coklat t.b
- 3. MEMBEDAKAN SO3 2- dan HSO3 - - UNTUK ZAT TUNGGAL SO3 2- + H2O HSO3 - + OH- BASA HSO3 2- + H2O NETRAL SO3 3- + H2O2 SO4 2- + H2O NETRAL HSO3 - + H2O2 SO4 2- + H++H2O ASAM - REAKSI UJI CAMPURAN CO3 2- DAN SO3 2- Campuran + K2Cr2O7 + H+ Cr3+ + CO2 + Ba(OH)2 BaCO3 putih Penambahan K2Cr2O7 harus dilakukan terlebih dahulu dari pada penambahan H+. MENGAPA ?
- 4. 4. REAKSI UJI S2- Penggolongan : 1. Ditambah H2SO4 2N gas KECUALI HgS, PbS, dll kation gol. IIA 2. Golongan Reduktor 3. Golongan AgNO3 merupan anion pengganggu golongan ini. Penetapan : 1. Ditambah H2SO4 2N: S2- + 2H+ H2S H2S + Pb2+ PbS + 2H+ 2. Ditambah larutan Pb(OAc)2 S2+ + Pb2+ PbS hitam 3. Ditambah larutan Cd(OAc)2 S2+ + Cd2+ CdS kuning
- 5. REAKSI UJI CH3COO- Penggolongan : 1. Ditambah H2SO4 2N gas bau cuka 2. Ditambah FeCl3 larutan merah [ Fe3(OH)2(OAc)6]+ Penetapan : 1. Ditambah H2SO4 / KHSO4 CH3COO- + H+ CH3COOH bau cuka 2. R. ESTERIFIKASI CH3COO- + H2SO4 pk + Etanol CH3COOCH2CH3+ H2 bau ester
- 6. REAKSI UJI CN- Penggolongan : 1. Ditambah H2SO4 2N gas HCN racun 2. Golongan AgNO3 anion pengganggu untuk golongan ini Penetapan: 1. H2SO4 : CN- + H + HCN HCN + ( NH4)2S3 HSCN + (NH4)2S FeCl3 + HSCN [Fe(SCN)]2+ + H+ + Cl- Merah 2. Prusian Blue test : Larutan Zat + NaOH + FeSO4 + HCl netral / Asam lemah, + FeCl3 endapan biru Berlin FeSO4 + 2NaOH Fe(OH)2 + Na2SO4 Fe(OH)3 + 2CN- Fe(CN)2 + 2OH- Fe (CN)3 + 4CN- Fe(CN)6 4- 3[Fe(CN)6]4- + 4FeCl3 Fe4[Fe(CN)6]3
- 7. REAKSI UJI NO2 - Penggolongan : 1. Ditambah H2SO4 2N gas berbau merangsang (coklat ) 2. Golongan oksidator 3. Golongan reduktor Penetapan: 1. Reaksi cincin coklat Larutan zat ( netral ) + FeSO4 ( baru ) + as. HOAc / H2SO4 encer melaui . dinding tabung reaksi cincin coklat. N2 - + CH3COOH HNO3 + CH3COO- 3HNO2 H2O + HNO3 + 2NO FeSO4 + NO Fe(NO)SO4 cincin coklat CATATAN Untuk NO3 - digunakan H2SO4 pekat beda dengan NO2 - Jika NO2 - digunakan as. Pekat seluruh larutan menjadi coklat.
- 8. Reaksi Diazo Larutan + CH3COOH + as. Sulfanilat + - naftilamin merah NaNO2 + CH3COOH HNO2 + CH3COONa Tiourea, CS(NH2)2 Larutan zat + HOAc encer + tiourea + FeCl3 merah NaNO2 + HOAc HNO2 + NaOAc HNO2 + CS(NH2)2 N2 + H+ + SCN- + 2H2O SCN- + H+ + Fe3+ FeCNS2+ merah SCN- dan I- mengganggu, harus dihilangkan dgn penambahan Ag2SO4 padat berlebih atau dgn AgNO3 sebelum pe an HOAc dan tiourea. MENGAPA ?
- 9. REAKSI UJI NO3 - • Penggolongan : 1. golongan oksidator • Penetapan : Reaksi cincin coklat - larutan zat + FeSO4 pk kocok kemudian ditambah H2SO4 pekat pelan pelan pada dinding tabung reaksi cincin coklat 2NO3 - + 4H2SO4 + Fe2+ Fe3+ + 2NO+ 4SO4 2- + H2O Fe2+ + NO [Fe(NO)]2+ coklat
- 10. Reaksi pembentukan cincin coklat diganggu oleh ion-ion : a.) NO2 - dihilangkan dengan cara: - ditambah asam sulfamat H2N – HSO3 + NO2 - N2 + SO4 2- + H+ + H2O - ditambah NH4Cl padat berlebih dan dipanaskan NO2 - + NH4 + N2 + 2H2O - ditambah tiourea N2 - ditambah urea N2 b) .I- ; Br- ; CIO3 - ; IO3 - ; SCN- ; Fe(CN)6 4- ; Fe(CN)6 3- dihilangkan dgn AgSO4 (bebas nitrat) berlebih c.) Reduksi NO3 – suasana basa - NO3 - + 4Zn + 7OH + 6 H2O NH3 + 4 [ Zn(OH)4 ]2 - - 3NO3- + 8Al + 5 OH- + 18 H2O - 3NH3 + 8 [Al(OH)4}- diganggu nitrit dihilangkan seperti diatas, dan jika ada amonia maka dipanaskan sampai amonia menguap semua.
- 11. 9. REAKSI UJI CNS- Penggolongan : 1. golongan reduktor 2. golongan AgNO3 3. golongan FeCl3 Penetapan : 1. Dengan larutan FeCl3 merah darah 3 SCN- + Fe3+ Fe(SCN)3 merah darah warna merah akan hilang (dihilangkan) oleh ion-ion F- ; Hg2+ ; C2O4 2- kompleks tak berwarna stabil Fe(SCN)3 + 6F- [FeF6]3- + 3 SCN- 4Fe(SCN)3 + 3Hg2+ 3[Hg(SCN)4]2- + 4Fe3+ Fe(SCN)3 + 3(COO)2 2- [Fe[(COO)2]3]3- + 3SCN-
- 12. 2. Dengan larutan Co(NO3)2 larutan biru 4SCN- + CO2+ [Co(SCN)4]2- beda dengan CN-, Fe(CN)6 4- dan Fe(CN)6 3- endapan biru 3. Dengan larutan Hg(NO3)2 dan Zn2+ 2SCN- + Hg2+ Hg(SCN)2 Hg(SCN)2 + SCN- [Hg(SCN)4]2- [Hg(SCN)4]2- + Zn2+ Zn{Hg(SCN)4] putih
- 13. REAKSI UJI Fe(CN)6 3- Penggolongan : - golongan oksidator - golongan AgNO3 - golongan FeCl3 Penetapan : 1. AgNO3 : Fe(CN)6 3- + Ag+ Ag3[Fe(CN)6] merah jingga 2. FeCl3 : Fe(CN)6 3- + Fe3+ FeFe(CN)6 coklat 3. FeSO4 : Fe(CN)6 3- +Fe2+ Fe4[Fe(CN)6]3 biru berlin 4. CuSO4 : 2Fe(CN)6 3- +Cu2+ Cu3[Fe(CN)6] hijau 5. Co(NO3)2 : 2Fe(CN)6 3- +3Co3+ CO3[Fe(CN)6]2 merah
- 14. REAKSI UJI HALOGEN Pendahuluan : reaksi nyala Beilstein Penggolongan : - golongan reduktor - golongan AgNO3 REAKSI UJI Cl- Penetapan 1. dengan AgNO3 putih yang larut dalam NH4OH 2N. Jika larutan + HNO3 2N. Jika larutan + HNO3 2N terjadi lagi endapan putih. Cl- + Ag+ AgCl Ag(NH3)2 + + Cl + HNO3 NH4NO3 + AgCl Putih Reaksi yang sama diberikan oleh SCN- 2. dengan Pb(OAc)2 putih (kristal jarum) Cl- + Pb2+ PbCl2 larut dalam air panas
- 15. B. REAKSI UJI Br- Penetapan - dengan AgNO3 AgBr kuning muda dgn NH4OH 6N larut +HNO3 kuning muda ( reaksi = Cl- ) - dengan Pb(OAc)2 kristal putih dipanaskan larut 2Br- + Pb2+ PbBr2 kristal putih - Fluorencein Test prinsip : Br2 + Fluorescein tetrabromofluorescein (eosin ) merah -Br- + PbO2 + CH3COOH Br2 + Pb(OAc)2 ∆ dikenakan kertas saring yang diberi larutan fluorescein jenuh dalam etanol 50 %
- 16. - Uji menggunakan air Klor atau Kaporit suasana HCl + CHCl3 Ca(OCl2)2 + HCl HOCl + CaCl2 kaporit Br- + OCl- + H+ Br2 + Cl- + H2O Br2 dalam CHCl3 warna lebih intensif berwarna coklat
- 17. C. REAKSI UJI I- Penetapan 1. + AgNO3 kuning AgI yang sukar larut dalam NH4OH pekat. 2. + Pb(OAc)2 kristal kuning PbI2 larut dalam air panas 3. + NaNO2 + CH3COOH I2 + amilum biru I- + 2NO2 - + 4H+ I2 + 2NO + 2H2O CN- mengganggu : I2 + CN- ICN + I- CN- dihilangkan dengan + NaHCO3 atau asam dan dipanaskan HCN 4. +air klor atau kaporit suasana HCl + CHCl3 I2 dalam CHCl3 ungu cara dan reaksi = Br-
- 18. 5.+ HgCl2 HgI2 jingga dengan pereaksi berlebih larut I- + Hg2+ HgI2 jingga HgI2 + I- [HgI4]2- larut 6. +Hg2(NO3)2 hijau + I- berlebih larut I- + Hg2 2+ Hg2I2 hijau Hg2I2 + I- [HgI4]2- + Hg hitam
- 19. D. REAKSI UJI F- - Golongan halogen yang tidak mengendap dengan AgNO3 + H2SO4 pk panas gas HF yang korosif terhadap gelas gas SiF4, apabila SiF4 dialirkan kedalam air gelatineus H2SiO3 NaF + H2SO4 pk NaHSO4 + HF HF + SiO2 SiF4 + H2O 3SiF4 + 4 H2O 2H2SiF6 + H2SiO3 Catatan : HF pada suhu kamar mengalami dimerisasi membentuk H2F2 sedangkan pada suhu > 90C bentuknya HF Penetapan 1.+ CaCl2 putih seperti lendir CaF2 yang sedikit larut dalam HOAc dan sedikit larut dalam HCl encer. 2.+ FeCl3 kristal putih 6NaF + FeCl3 Na3[FeF6] kristal putih + 3 NaCl
- 21. Reaksi lihat dengan B
- 22. A. REAKSI UJI ClO3 - Penetapan : 1.+larutan AgNO3 bila larutan diasamkan dengan HNO3 encer dan + larutan NaNO2 AgCl ClO3 - + NO2 - Cl- + NO3 - Cl- + AgNO3 AgCl putih 2.+larutan Kl suasana asam mineral ( H2SO4 ) I2 +amilum biru ClO3 - + I- dalam suasana H+ Cl- + I2 + H2O Catatan : bila asam organik (HOAc ) I2 beda dengan IO3 - +Reduksi dengan NaNO2 + HNO3 Cl- selanjutnya dilakukan penetapan Cl
- 23. REAKSI UJI BrO3 - Penetapan : larutan + AgNO3 : bila [ BrO3 -]>> putih AgBrO3 yang larut dalam air panas dan larutan NH4OH encer. BrO3 - + Ag+ AgBrO3 AgBrO3 + 2NH3 [Ag(NH3)2]+ + BrO3 - Bila [ BrO3 -]>> BrO3 - + Ba2+ Ba(BrO3)2 BrO3 - + Pb2+ Pb(BrO3)3 BrO3 - + Hg2 2+ Hg2(BrO3)2 Bila + NaNO3 atau Na2SO3 (suasana HNO3) + AgNO3 AgBr BrO3 - direduksi Br- penetapan Br-
- 24. Reduktor : Gas SO2 : SO2 + H2O H2SO3 BrO3 - + SO3 2- Br- + SO4 3- Gas H2S : BrO3 - + 3H2S Br- + S + H2O Larutan NaNO2 : BrO3 - + NO2 - Br- + NO3 -
- 25. C. REAKSI UJI IO3 - Penetapan : +larutan AgNO3 ( suasana HNO3 encer ) putih yang larut dalam NH4OH encer IO3 - + Ag+ AgIO3 AgIO3 + 2NH3 [ Ag(NH3)2]+ + IO3 - Jika larutan amoniakal ini + H2SO3 AgI kuning Yang sukar larut dalam NH4OH pk berbeda dengan BrO3 - [ Ag(NH3)2]+ + IO3 - + 3H2SO3 AgI + 3SO4 2- + NH4 + + 4H+ +larutan BaCl2 putih Ba(IO3)2 beda dengan ClO3 - yang sangat sedikit larut dalam air panas maupun HNO3 encer ( beda dengan I- ), jika endapan ini dicuci + H2SO3 dan CCl4 I2 ungu dalam lap. CCl4 IO3 - + Ba2+ Ba ( IO3)2 Ba(IO3)2 + H2SO3 I2 + BaSO4 + 4SO4 2- + 8H+ + H2O
- 26. • larutan Hg(NO3)2 putih Hg( IO3)2 beda dengan ClO3 - dan BrO3 - ) • dengan PbOAc putih • dengan HgCl2 ( HgCl2 praktis tidak terionisasi, kovalen ) 2IO3 - + Hg2+ Hg(IO3)2 IO3 - + Pb2 + Pb (IO3)2 • uji dengan KSCN, kertas amilum + larutan KSCN suasana asam bercak biru 6IO3 - + 5SCN- + H+ + H2O 3I2 + 5HSCN + 5SO4 2-
- 27. 14. REAKSI UJI BORAT 3 macam bentuk asam borat: asam ortoborat : H3BO3 asam piroborat : H2B4O7 asam metaborat : HBO2 H3BO3 sedikit larut dalam air dingin larut H3BO3 100 C HBO2 H3BO3 140 C H2B4O7 Kebanyakan, garam diturunkan dari asam meta dan piro ( contoh : Na2B4O7 ( boraks ) ) Garam – garam ini alam air terhidrolisis bereaksi alkalis BO3 3- + 3H2O H2BO2 + 3OH- B4O7 3- + 7H2O 4H3BO3 + 3OH- BO3 - + 2H2O H3BO3 + OH-
- 28. Pendahuluan : nyala api hijau Penggolongan : Golongan BaCl2 positip jika [ BO3 3-] Penetapan : 1. + larutan AgNO3 putih AgBO2 ( jika larutan pekat ) yang larut dalam NH4OH encer maupun HOAc. Jika endapan + air dan dipanaskan terhidrolisis Ag2O B4O7 3- + 4Ag+ + H2O AgBO2 + 2H+ 2AgBO2 + H2O Ag2O + H3BO3 coklat 2. +H2SO4 pk dan alkohol Cara : zat padat / larutan + H2SO4 pk + methanol dalam cawan porselan dinyalakan nyala hijau. Diganggu oleh Ba dan Cu
- 29. Cara mengatasinya : Campuran zat + serbuk CaF + H2SO4 pk pasta. Pasta tersebut dibakar ( dengan pertolongan pengaduk kaca ) nyala hijau. BO3 2+ + CaF2 BF3 yang mudah menguap nyala hijau BaF2 dari CuF2 sukar menguap. Reaksi : H3BO3 + 3CH3OH B(OCH3)3 + 3H2O nyala hijau *kertas kurkumin ( turmetrik ) Larutan zat + HCl encer , teteskan pada kertas saring kurkumin , dipanaskan 100 oC akan timbul warna merah dan dalam suasana basa menjadi berwarna biru/ hijau kehitaman.
- 30. 15. UJI SO4 2- Penggolongan : BaCl2 Penetapan : 1. Larutan BaCl2 putih BaSO4 yang sukar larut dalam asam-asam mineral encer panas, larut sedang dalam HCl pekat mendidih BaSO4 + SO4 2- BaSO4 2. Larutan Pb(OAc)2 PbSO4 yang larut dalam H2SO4 pekat panas, dalam NH4OAc dan NH4- Pb2+ + SO4 2- PbSO4 3. Larutan CaCl2 : kristal spesifik CaSO4 4. Larutan Hg(NO3)2 kuning merkuri sulfat basa SO4 2- + 3Hg2+ + H2O HgSO4.2HgO + H+
- 31. 16. REAKSI UJI S2O8 2- (Peroksodisulfat) Penggolongan : - golongan oksidator - golongan BaCl2 2S2O8 2- + H2O 4SO4 2- + 4H+ + O2 Penetapan 1. + larutan AgNO3 hitam Ag2O2 S2O8 2- + Ag+ + H2O Ag2O2 + HSO4 - + 2H+ Jika AgNO3 yang akan sedikit dan diikuti penambahan NH4OH N2 dan panas 3S2O8 2- + 8NH3 N2 + 6SO4 2- + 6NH4+ 2. ditambah larutan KI I2 + amilum ……biru
- 32. 3. ditambah larutan MnSO4 suasana alkali / netral coklat S2O8 2- + Mn2+ + 4OH- MnO2.2H2O + 2SO4 2- + H2O Suasana asam (HNO3, H2SO4) + sedikit AgNO3 dan dipanaskan ungu MnSO4 + 5H2S2O8 2HMnO4 + 12H2SO4 ungu 17. REAKSI UJI FOSFAT Ada tiga macam bentuk dari asam fosfat : - ortho-fosfat : H3PO4 - piro-fosfat : H4P2O7 - meta-fosfat : HPO3
- 33. Garamnya yang paling stabil adalah garam ortho fosfat. Berdasarkan martabatnya, ortho fosfat membentuk 3 macam garam : - ortho fosfat primer : NaH3PO4 - ortho fosfat sekunder : Na2HPO4 - ortho fosfat tersier : Na3PO4 Garam Na-nya yang paling stabil dalam air adalah NaH3PO4 dan Na2HPO4 Garam normalnya, Na3PO4 dalam air terhidrolisis NaOH + H3PO4
- 34. 18. REAKSI UJI PO4 3- Penggolongan : - golongan AgNO3 (tetapi untuk meta dan piro negatip) - golongan BaCl2 - golongan FeCl3 Penetapan : 1. Larutan AgNO3 endapan kuning Ag3PO4 yang larut dalam NH4OH dan HNO3 Na3HPO4 + 3AgNO3 Ag3PO4 + NaNO3 + HNO3 2. Campuran magnesia (magnesia mixture).
- 35. Campuran magnesia Mg(NO3)3 atau MgCl2 HNO3 NH4Cl NH4OH NH4OH PO4 3- + campuran magnesia kristal putih yang larut dalam asam mineral maupun HOAc Na2HPO4 + Mg(NO3)3 + NH3 Mg(NH4)PO4 + NaNO3 3. Pereaksi amonium molibdat kuning amonium fosfomolibdat - (NH4)3(PMo12O40) -(NH4)3[(P(Mo3O10)4] larut dalam NH4OH dan NaOH Reaksi berlangsung dalam suasana asam HNO3 yang kuat (1:1). Reaksi dipercepat dengan pemanasan pada suhu 40 C dan dengan NH4NO3
- 36. • Adanya HCl dalam jumlah besar, mengganggu reaksi dihilangkan dengan penguapan dengan + HNO3 berlebih. Na3HPO4 + 12(NH4)3 MoO4 + 23 HNO3 (NH4).(P(Mo12O40)) + 2NaNO3 + 21 NH4NO3 + 12H2O • Arsenat : AsO4 3- memberikan reaksi yang sama amonium arseno molibdat BEDANYA : - bentuk kristalnya - endapan + NH4OAc larut setelah dingin : - amonium arseno molibdat putih - amonium fosfomolibdat tidak ada endapan - gutzeit : AsO4 2- positip PO4 3- negatip - H2S : AsO4 2- positip PO4 3- negatip
- 37. 4. Amonium molibdat – benzidin test - Reaksi redoks ant. grm/as. fosfomolibdat dgn benzidin, dimana terjadi 2 macam hasil reaksi yg keduanya berwarna biru. - hasil reaksi oksidasi : benzidine benzidin biru - hasil reduksi : molibdat molibdat biru Arsenat dan silikat hasil yang sama, dapat dicegah dengan penambahan as. Tartnat – ammolibdat. H2O2 , C2O4 2- dan mengganggu pengendapan forfomolibdat tidak boleh ada.