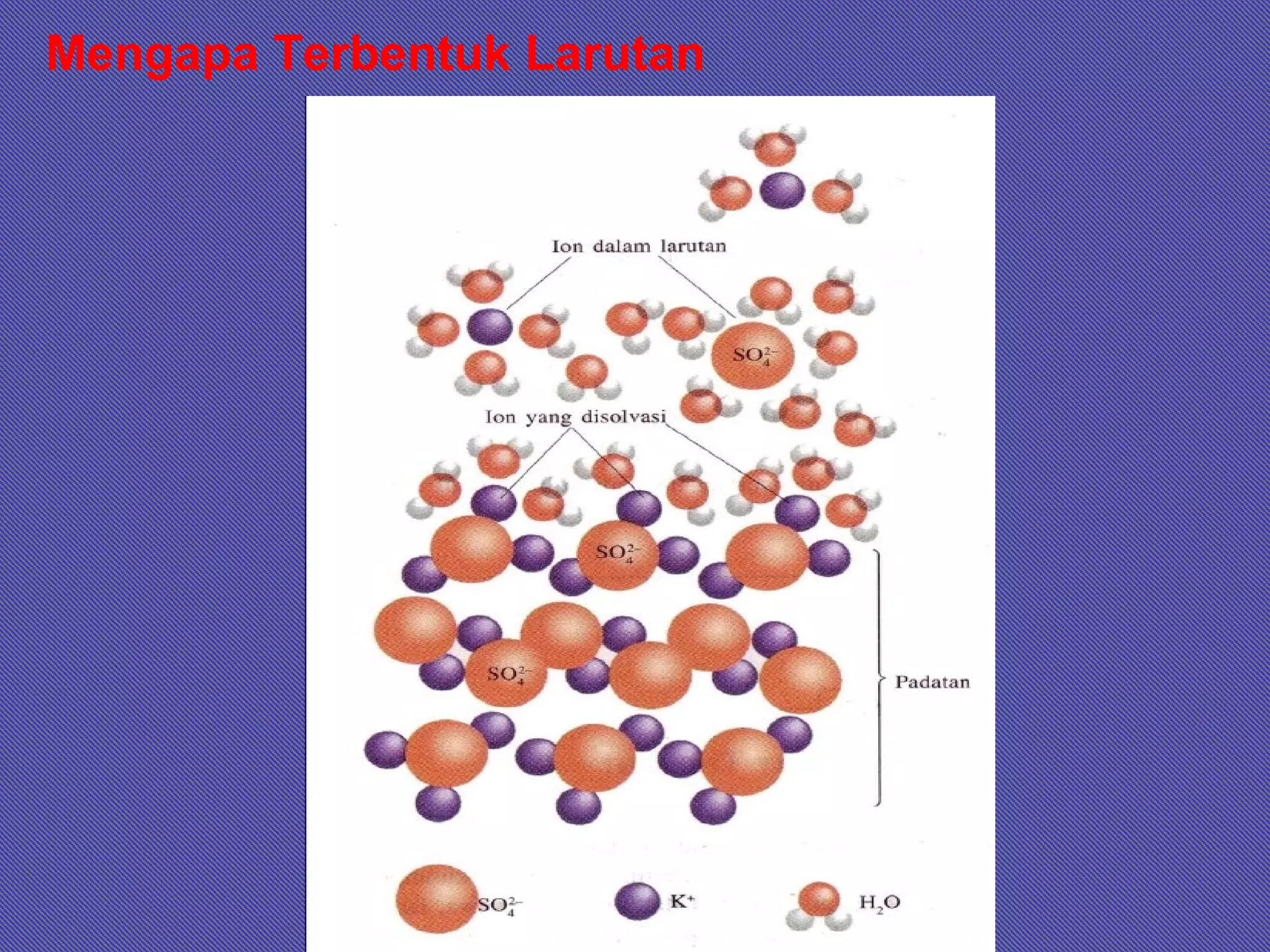
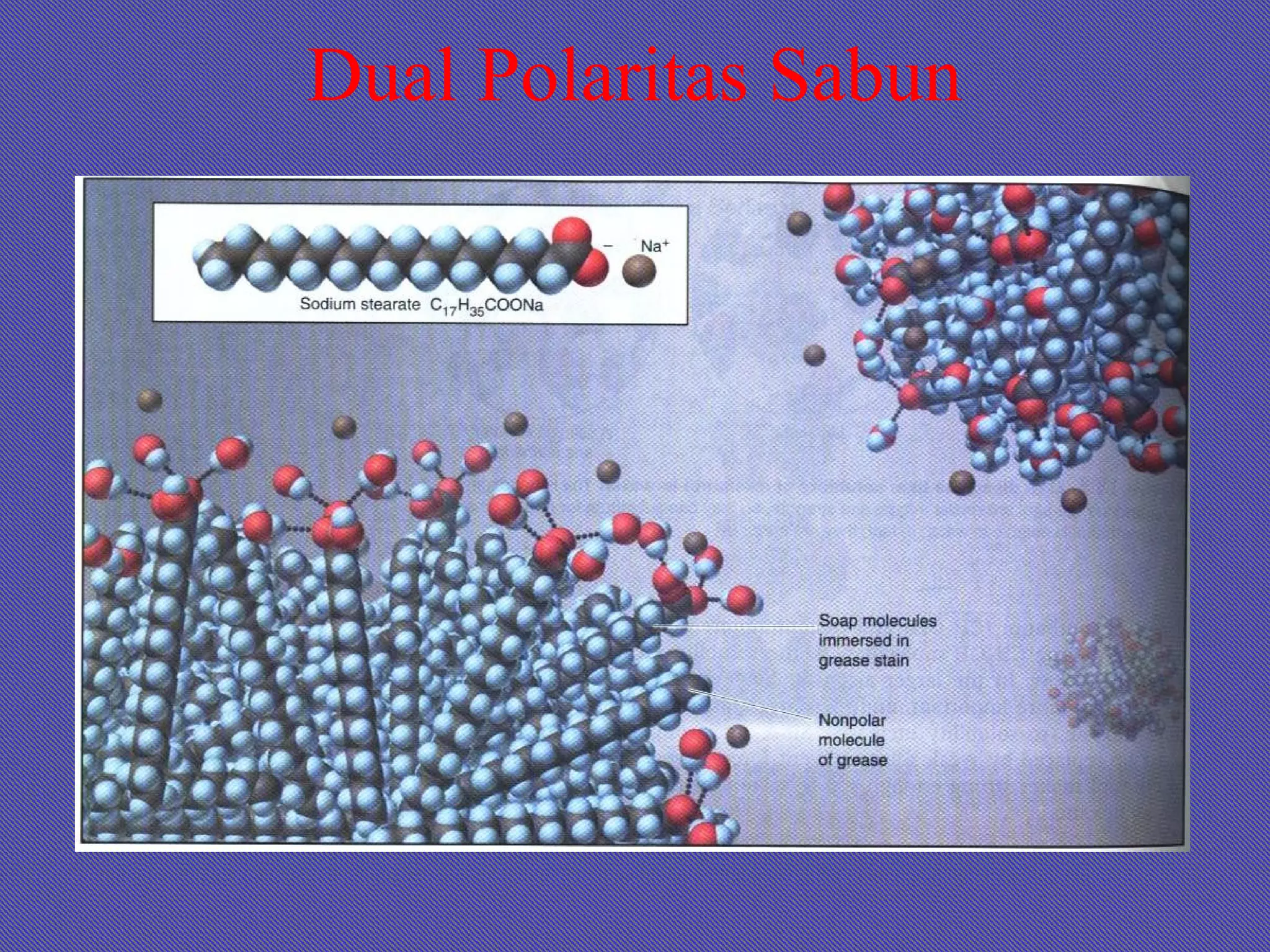
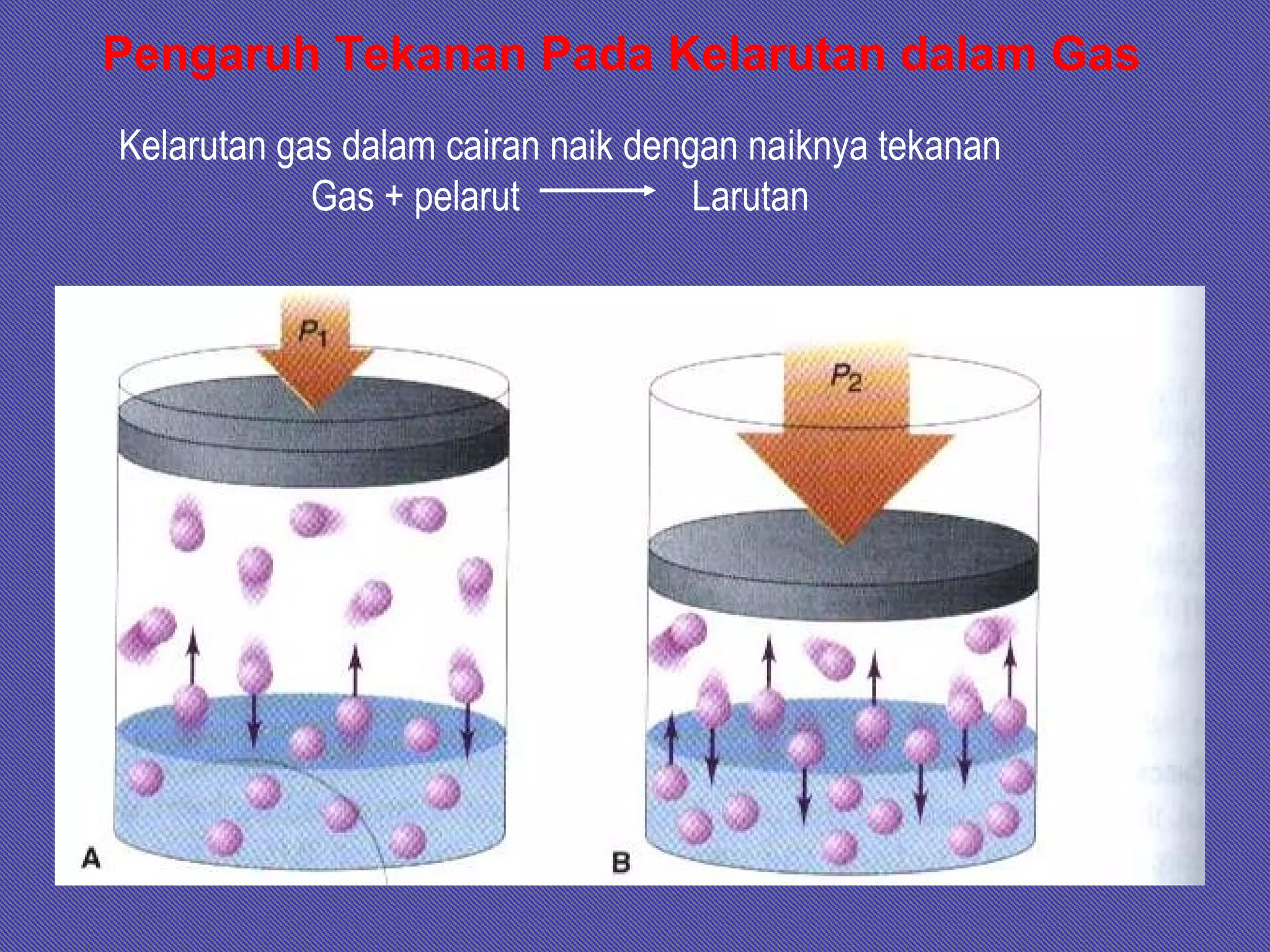
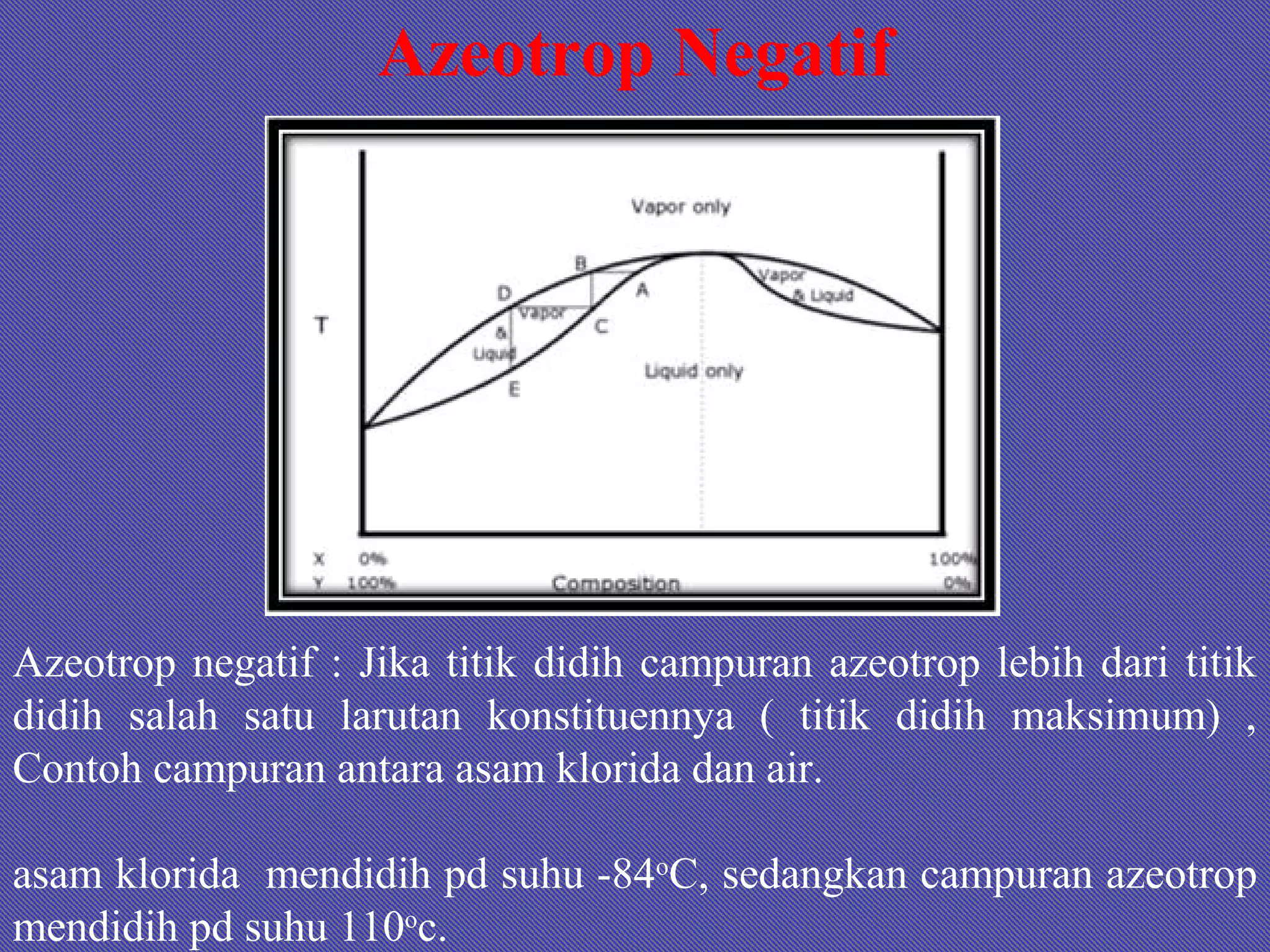
Dokumen ini membahas tentang larutan, termasuk definisi, jenis, komposisi, dan konsentrasi, serta sifat-sifat terkait seperti kelarutan dan hukum gas ideal. Terdapat penjelasan tentang larutan ideal dan non-ideal, termasuk penyimpangan dari hukum Raoult dan konsep azeotrop. Juga diberikan contoh soal untuk menghitung berbagai aspek terkait larutan.