Dokumen tersebut membahas tentang kinetika kimia, khususnya hukum laju reaksi. Hukum laju reaksi menyatakan hubungan antara laju reaksi dengan konsentrasi reaktan, dan dapat ditentukan melalui eksperimen untuk mengukur orde reaksi masing-masing reaktan. Plot grafik bentuk integral yang sesuai, seperti konsentrasi vs waktu, ln konsentrasi vs waktu, atau 1/konsentrasi vs wak

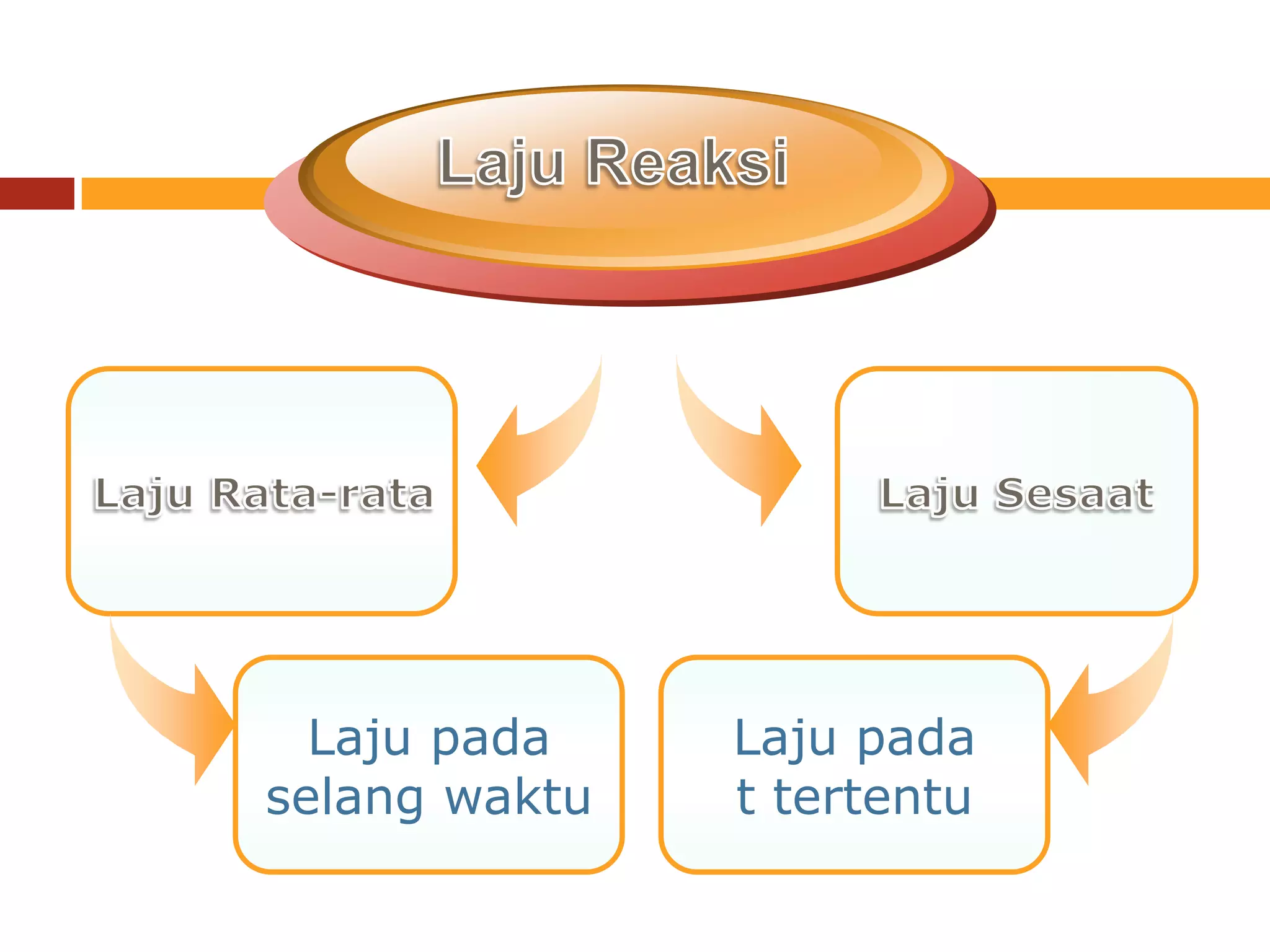
![Laju reaksi (r)
3
Perubahan konsentrasi reaktan atau produk
terhadap waktu
Pengurangankonsentrasi reaktan Dengan
Penambahan konsentrasi produk berjalannya
waktu
Secara matematis, untuk reaksi:
AB
Laju reaksi = r = -d[A]/dt = d[B]/dt](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-3-2048.jpg)
![Laju Reaksi & Stoikiometri
4
aA+bB→cC+dD
Laju reaksi = laju hilangnya reaktan
1 Δ[A] 1 Δ[B]
=- =-
a Δt b Δt
= laju munculnya produk
1 Δ[C] 1 Δ[D]
= =
c Δt d Δt](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-4-2048.jpg)

![ Misalkan pada reaksi berikut:
CH4 (g) + 2O2 (g) CO2 (g) + 2H2O (g)
Untuk setiap molekul metana yang terurai, 2 molekul oksigen
terurai
Untuk setiap molekul metana yang terurai, terbentuk 1
molekul karbondioksida dan 2 molekul air
laju = - [CH4] = - 1 [O2] = [CO2]= 1 [H2O]
t 2 t t t
2
Misalkan untuk reaksi: 2 NO2(g) 2 NO(g) + O2(g)
Tuliskan laju reaksi pengurangan konsentrasi nitrogen dioksida
sebagai fungsi dari laju pembentukan oksigen](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-6-2048.jpg)
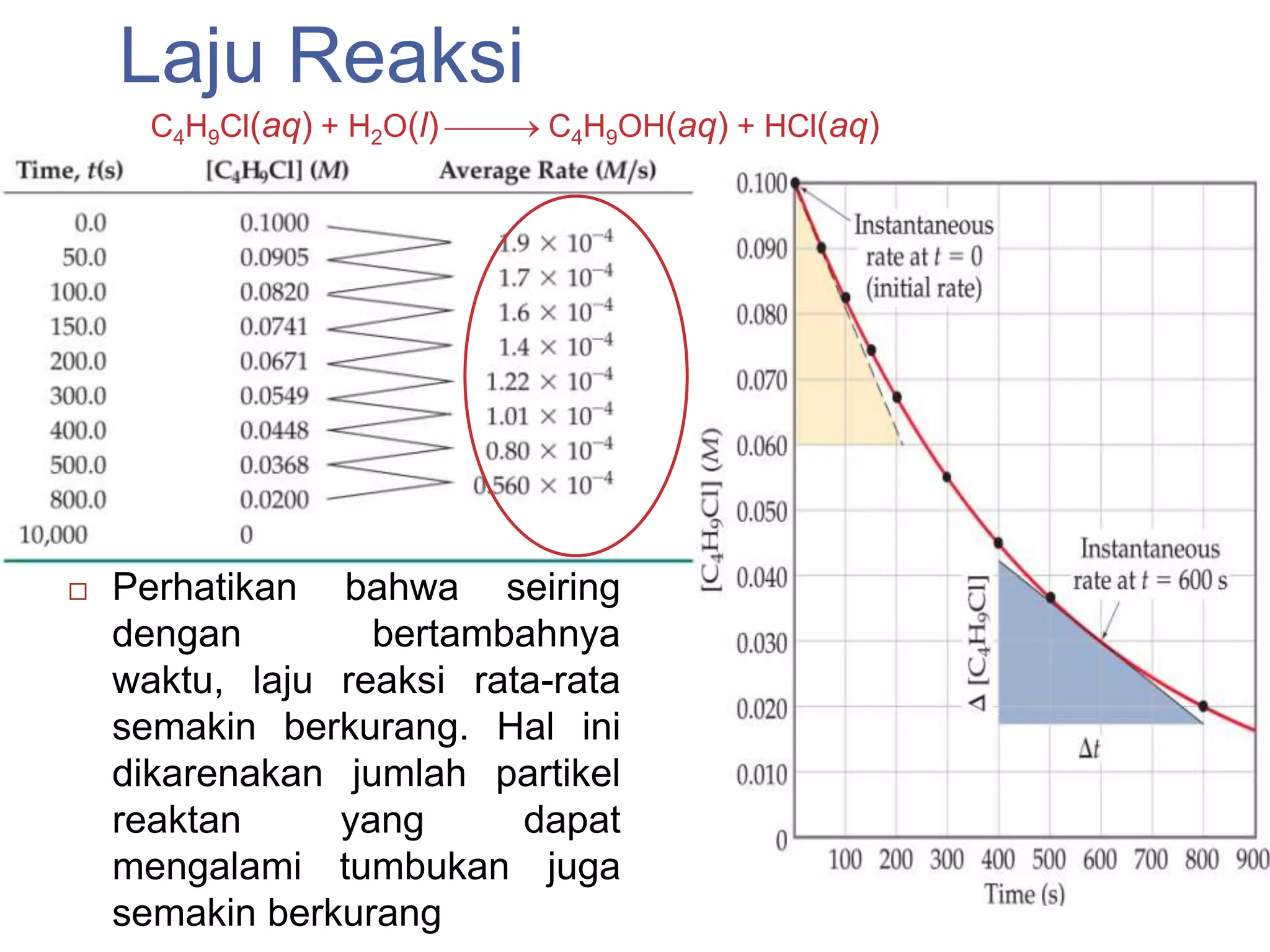
![Hukum Laju Reaksi
Hukum laju reaksi menyatakan bagaimana
konsentrasi dari suatu reaktan akan
mempengaruhi laju reaksi secara keseluruhan
Seberapa besar pengaruh konsentrasi dari salah
satu reaktan terhadap laju reaksi dinyatakan
dalam orde reaksi
Hukum laju reaksi merupakan fungsi dari reaktan
dan temperatur
Secara umum, untuk reaksi:
aA + bB + … cC + dD + …
hukum laju reaksinya adalah:
Persamaan laju reaksi = k[A]m[B]n ...](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-8-2048.jpg)
![Hukum Laju Reaksi
Untuk reaksi aA + bB + … xX + yY + …
laju reaksi sebagai fungsi perubahan konsentrasi reaktan
atau produk dinyatakan sebagai:
laju = - [A]/ t = [X]/ t
dengan persamaan laju reaksi = k[A]m[B]n[C]p
Komponen dalam suatu hukum laju reaksi:
[A]; [B]; … = konsentrasi reaktan
[C] = konsentrasi katalis (optional)
m; n;… = orde reaksi dari reaktan
m + n + … = orde reaksi total
Make a mental note, bahwa orde reaksi TIDAK TERKAIT
dengan koefisien dari persamaan laju reaksi](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-9-2048.jpg)



![Hukum Laju Reaksi
Bandingkan hasil eksperimen 1 dan 2:
ketika [NH4+] dinaikkan dua kali lipat, laju reaksi
bertamabah dua kali lipat](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-14-2048.jpg)
![Hukum Laju Reaksi
Bandingkan hasil eksperimen 5 dan 6:
ketika [NO2-] dinaikkan dua kali lipat, laju reaksi
bertambah dua kali lipat](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-15-2048.jpg)

![Reaksi Orde 0
[A]
rate = - rate = k [A]0 = k
t
[A]t adalah konsentrasi A pada saat t
[A]0 adalah konsentrasi A at saat t=0
[A] - [A]0 = kt](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-17-2048.jpg)
![Orde 0: [A] vs t; garis lurus
18
Pers. Garis:
[A] = - kt + c
Menentukan k:
k = - slope
Intersep c = [A]o](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-18-2048.jpg)
![Reaksi Orde 1
[A]
rate = -
t
rate = k [A] [A] = [A]0e-kt
ln[A] - ln[A]0 = - kt](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-19-2048.jpg)
![Orde 1: ln [A] vs t; garis lurus
20
Pers. Garis:
ln [A] = - kt + c
k = - slope
Intersep c = ln [A]o](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-20-2048.jpg)
![Reaksi Orde Dua
[A] 1 1
rate = - rate = k [A]2 - = - kt
t [A] [A]0](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-21-2048.jpg)
![Orde 2: 1/[A] vs t; garis lurus
22
Pers. Garis:
1/[A] = kt + c
Menentukan k:
k = slope
Intersep c = 1/[A]o](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-22-2048.jpg)
![23
Pers. Laju Reaksi
Bentuk
Bentuk
Diferensial: Integral:
mis. Orde 1:
-d[A]/dt = [A]m ln [A] = -kt + ln [A0]
Konsentrasi
Laju sesaat sebagai
fungsi waktu](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-23-2048.jpg)
![24
Ikhtisar Pers. Laju Reaksi
Orde 0 1 2
Hukum Laju
(Diferensial)
Hukum Laju
(Integral)
Plot Garis
[A] vs t ln [A] vs t 1/[A] vs t
Lurus
k - slope - slope slope
Satuan k M/s 1/s 1/(M.s)](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-24-2048.jpg)
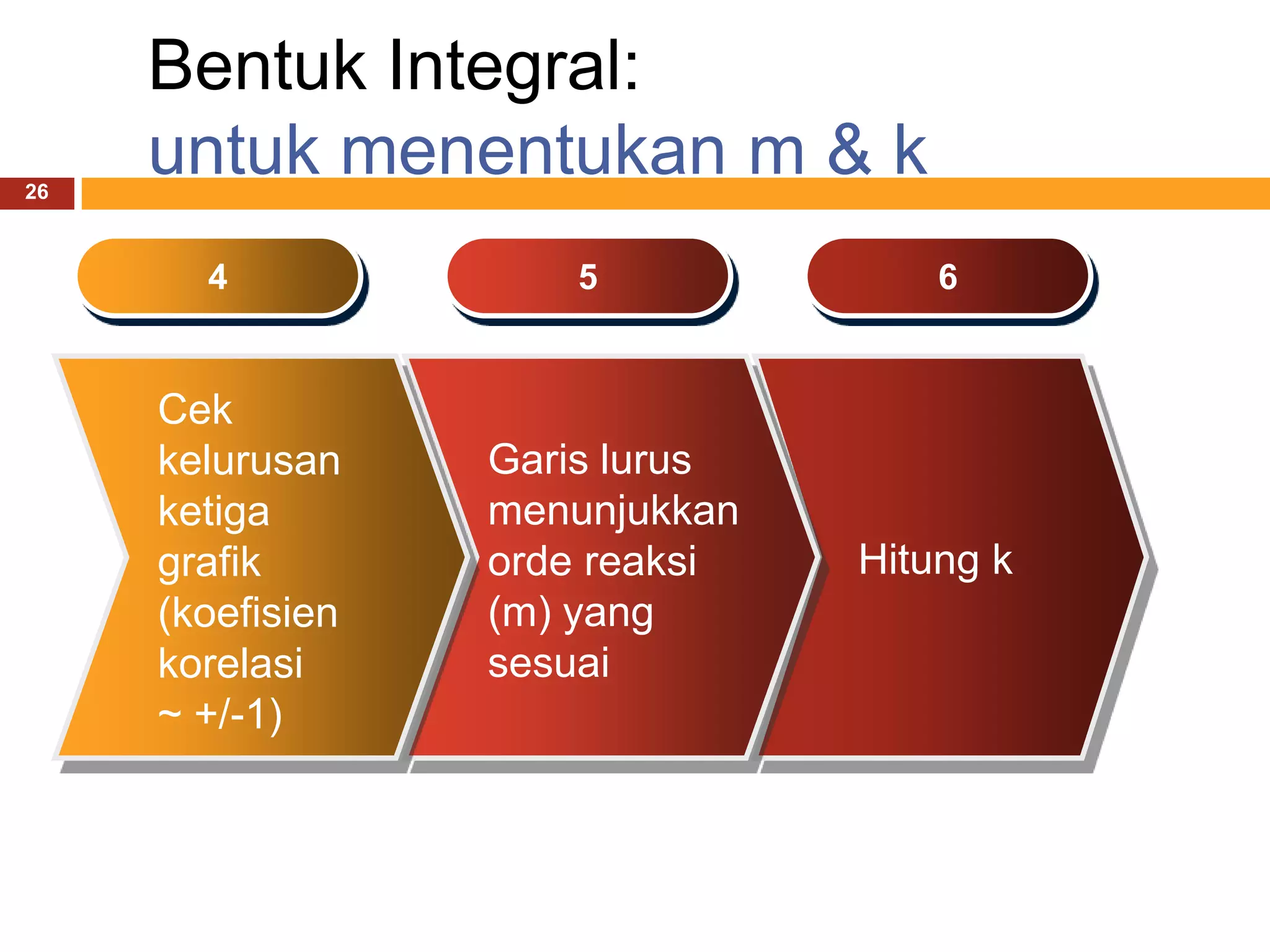
![Bentuk Integral:
25
untuk menentukan m & k
1 2 3
Lakukan Cek [A]t Buat plot:
reaksi tiap selang 1. [A] vs t
dengan [A]o waktu 2. ln [A] vs t
tertentu. tertentu 3. 1/[A] vs t](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-25-2048.jpg)
![Laju sesaat:
dapat dihitung jika m & k diketahui
27
- d[A]/dt = k [A]m
Konstanta Orde reaksi
Laju sesaat laju
Plot garis lurus
bentuk integral yang sesuai](https://image.slidesharecdn.com/kinetikakimiapertemuan4-130305102510-phpapp01/75/Kinetika-kimia-pertemuan-4-27-2048.jpg)