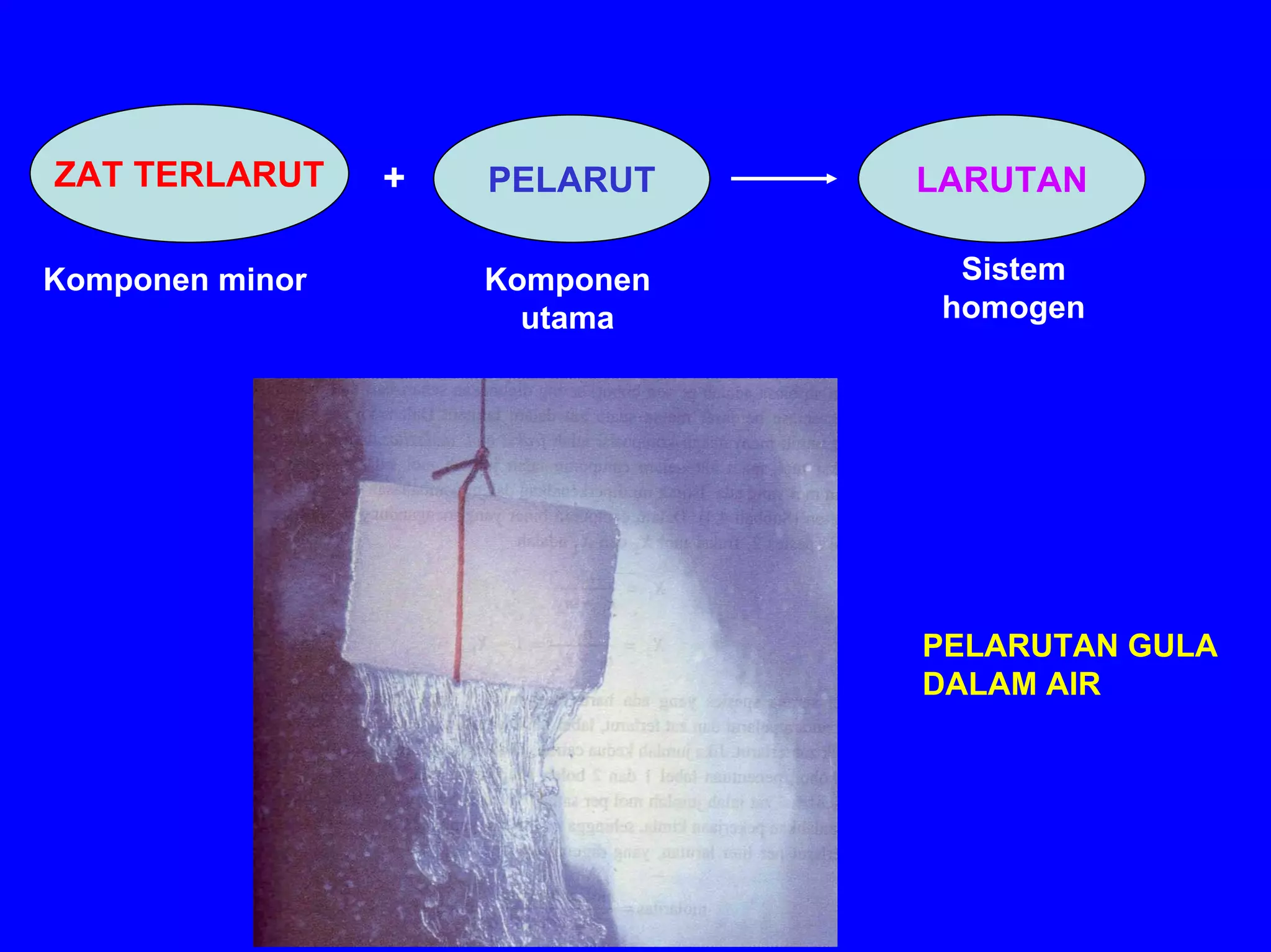
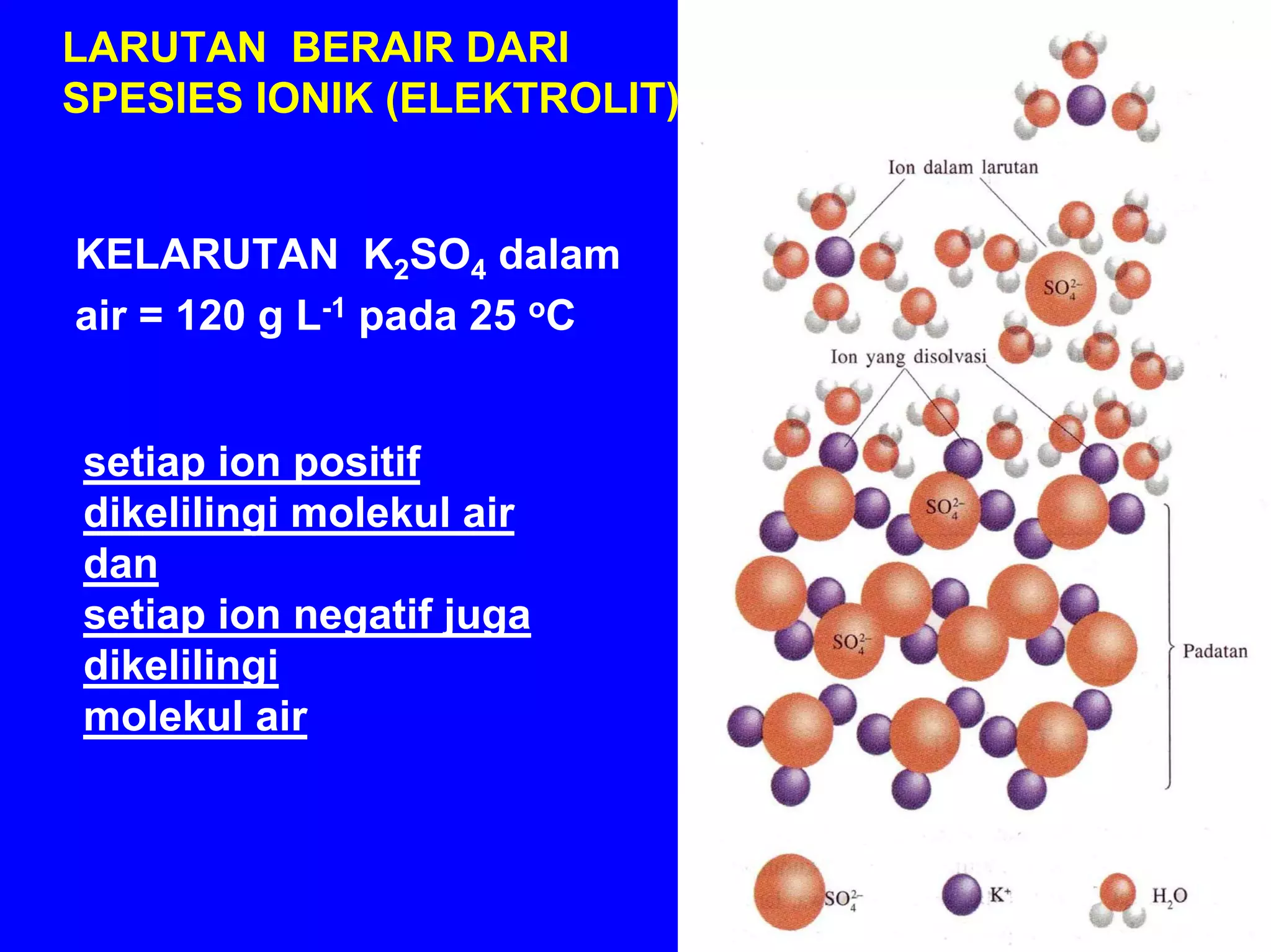
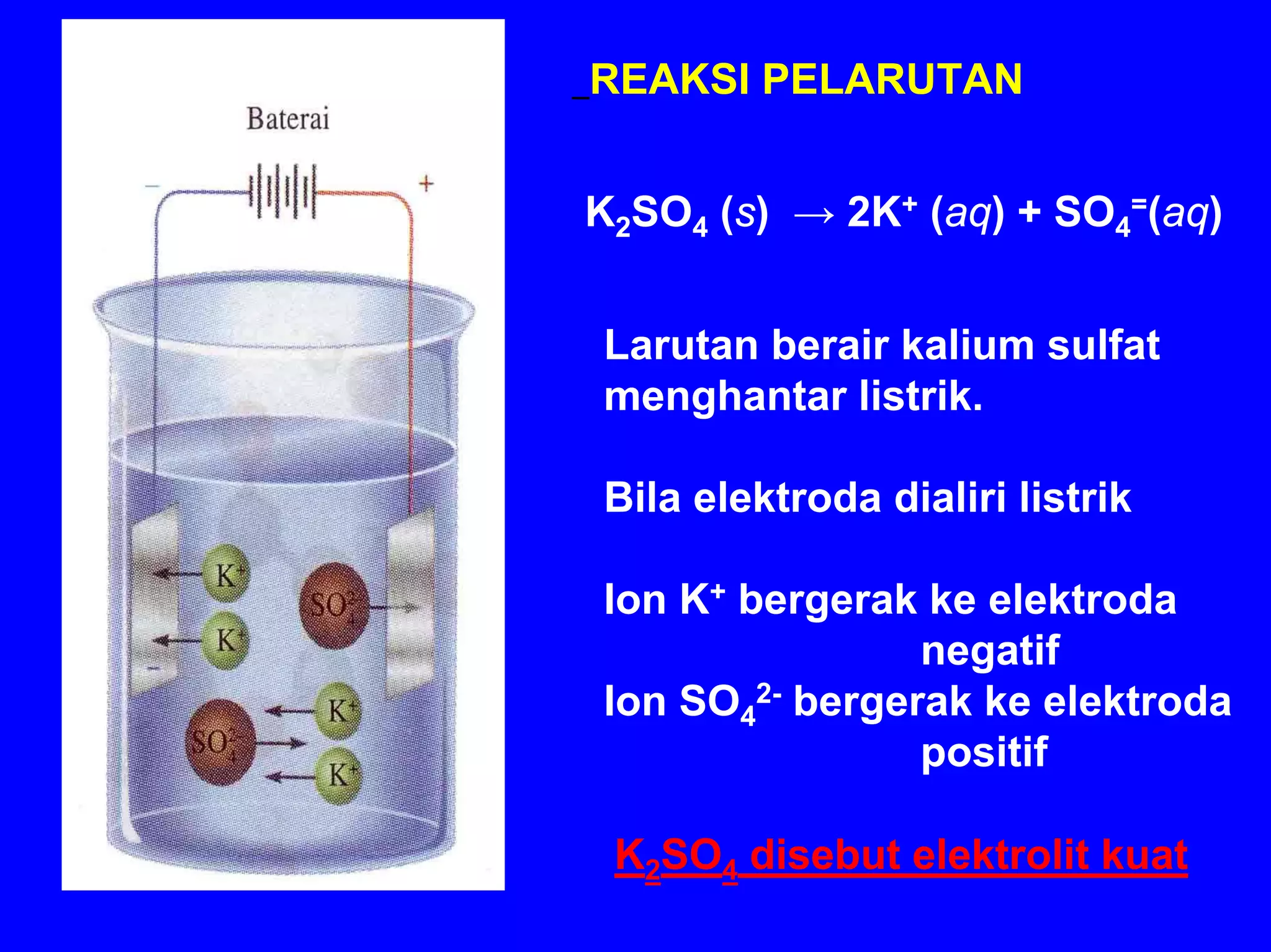
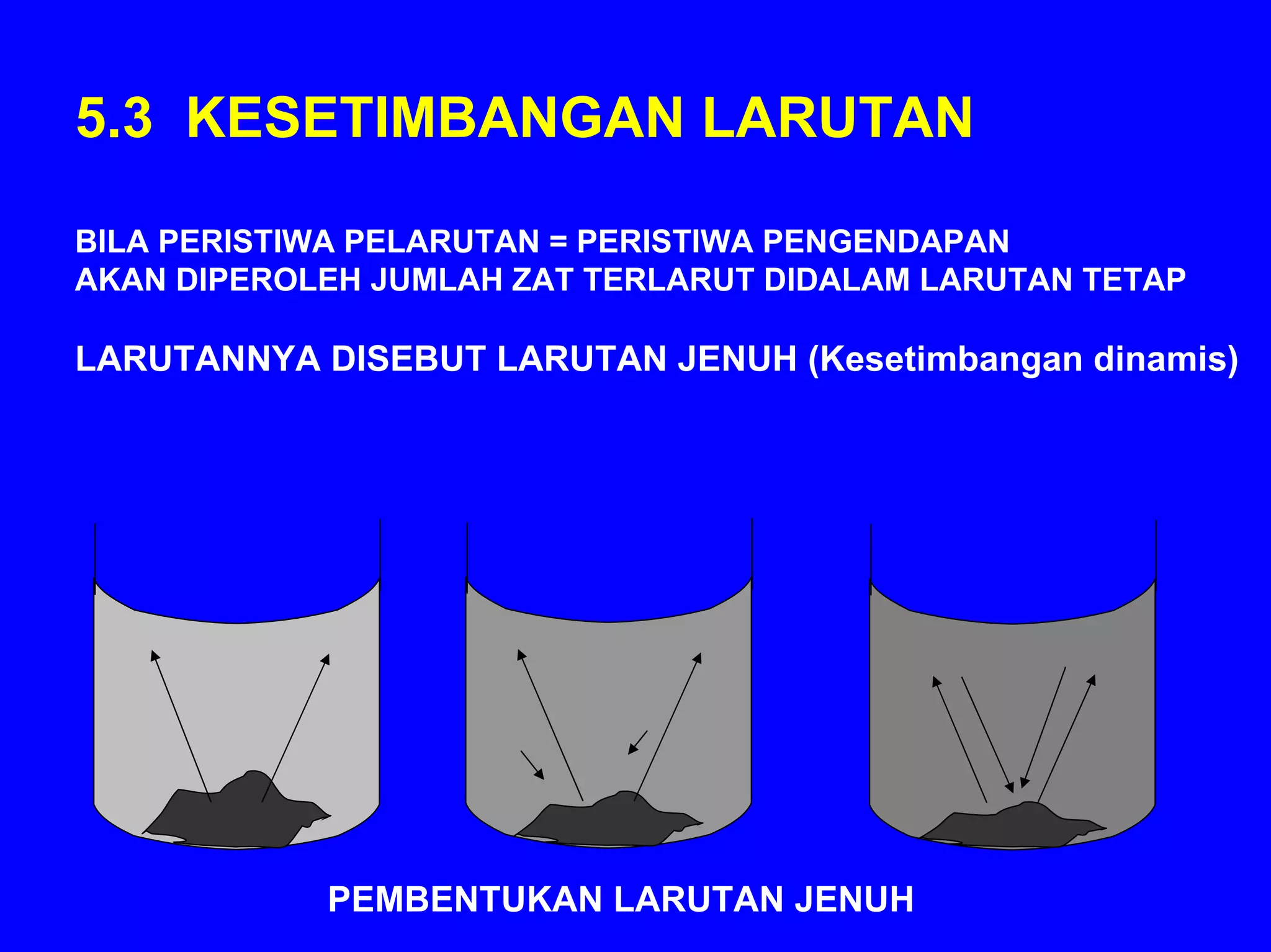
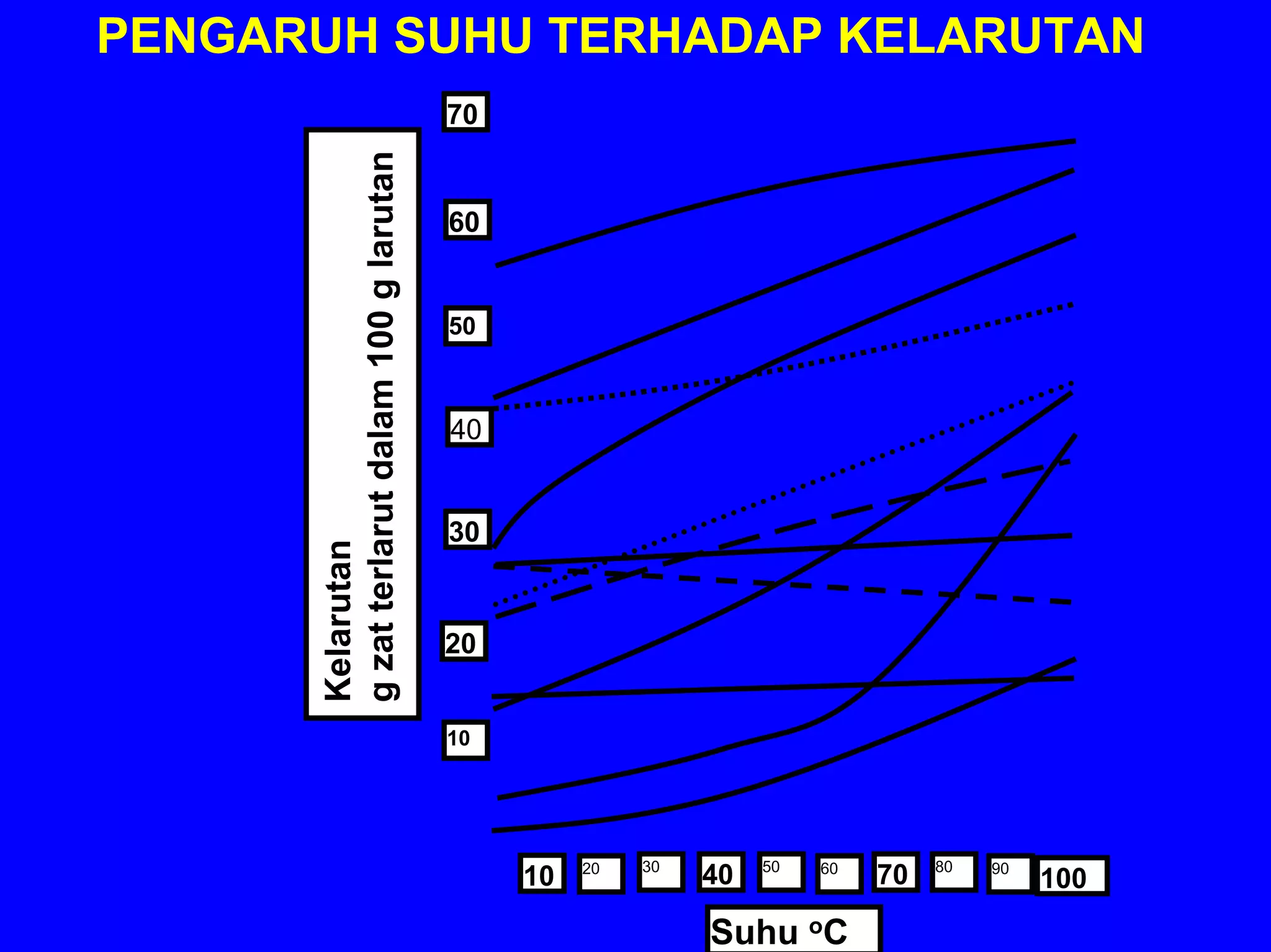
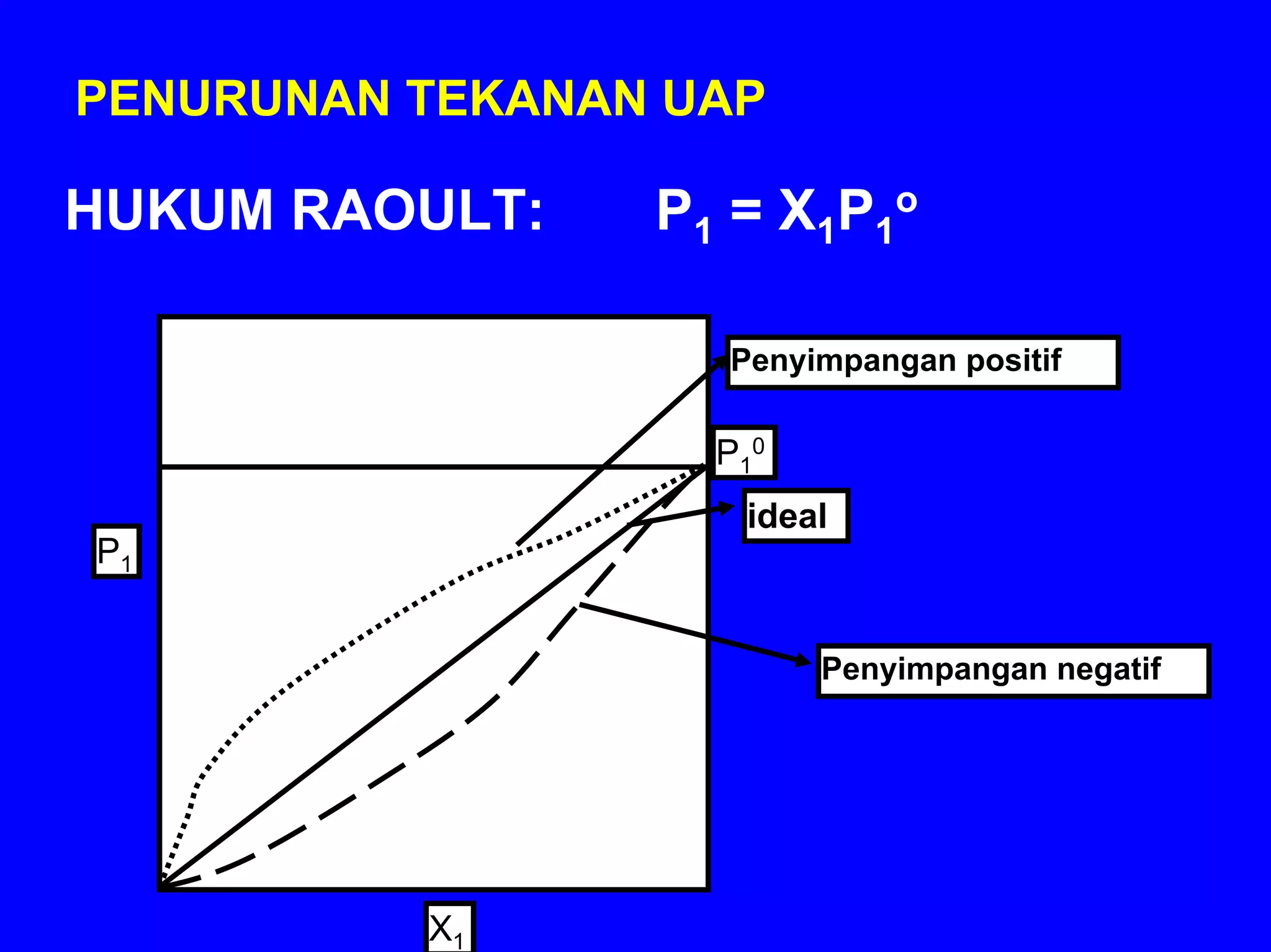
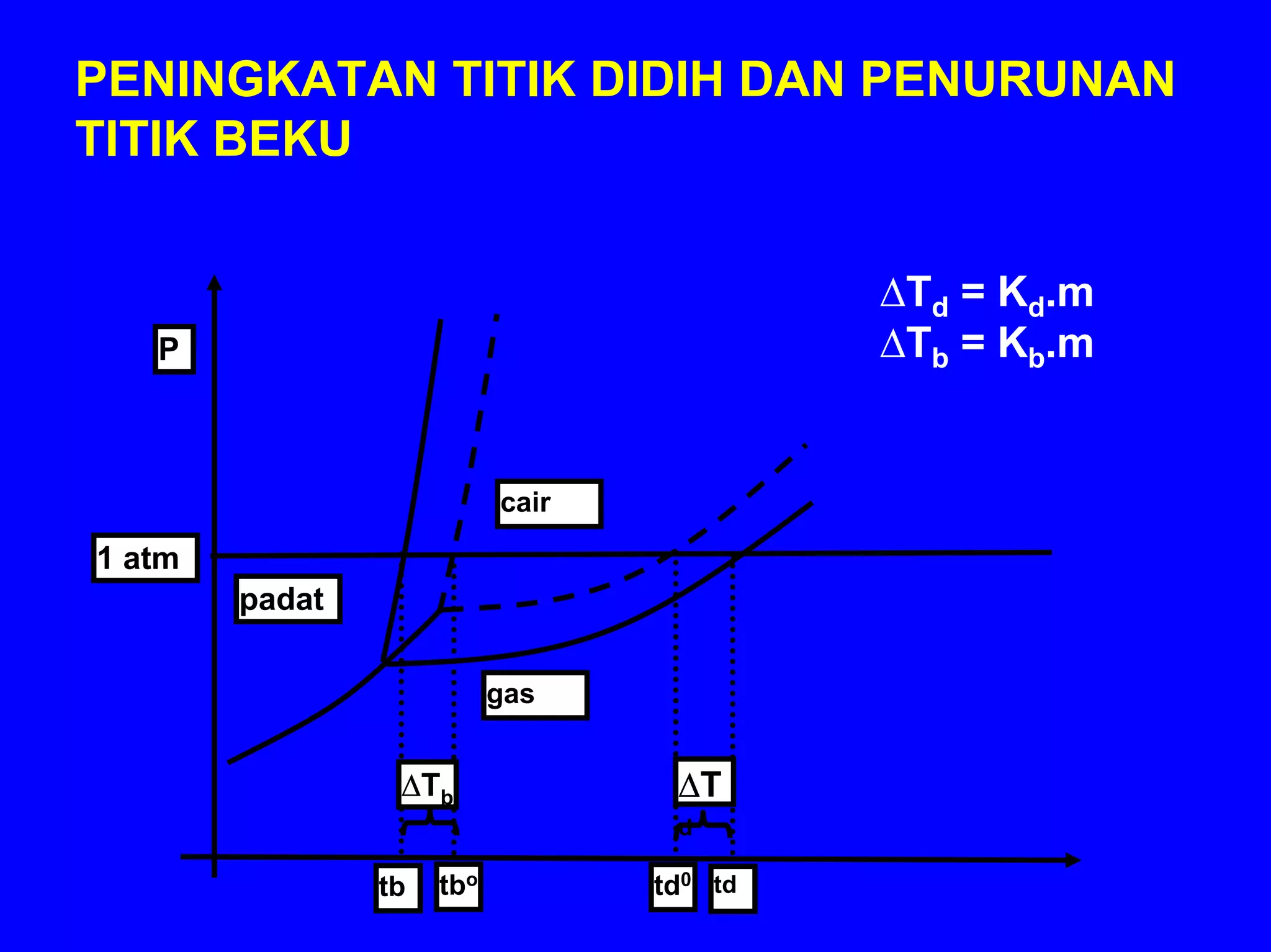
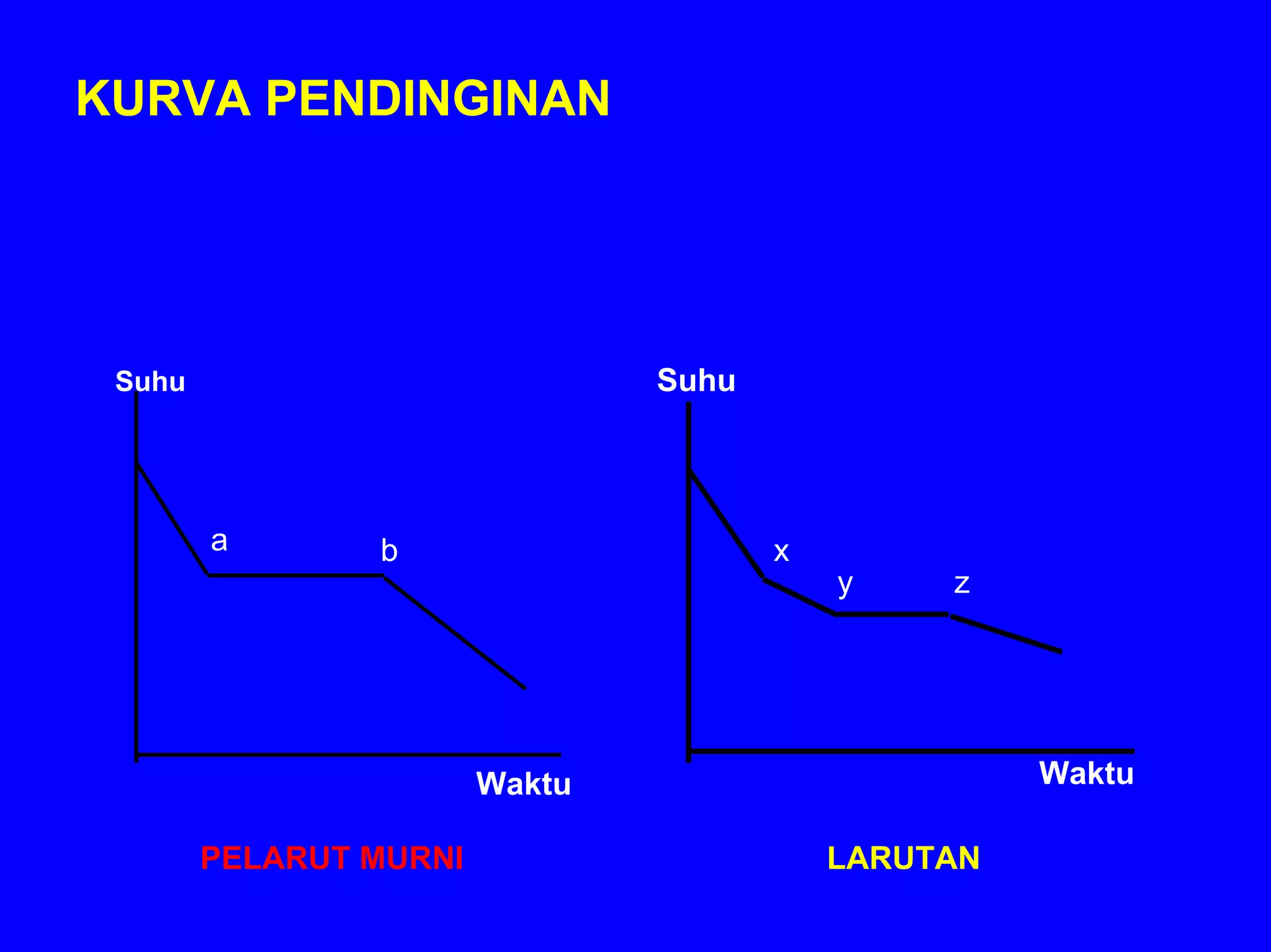
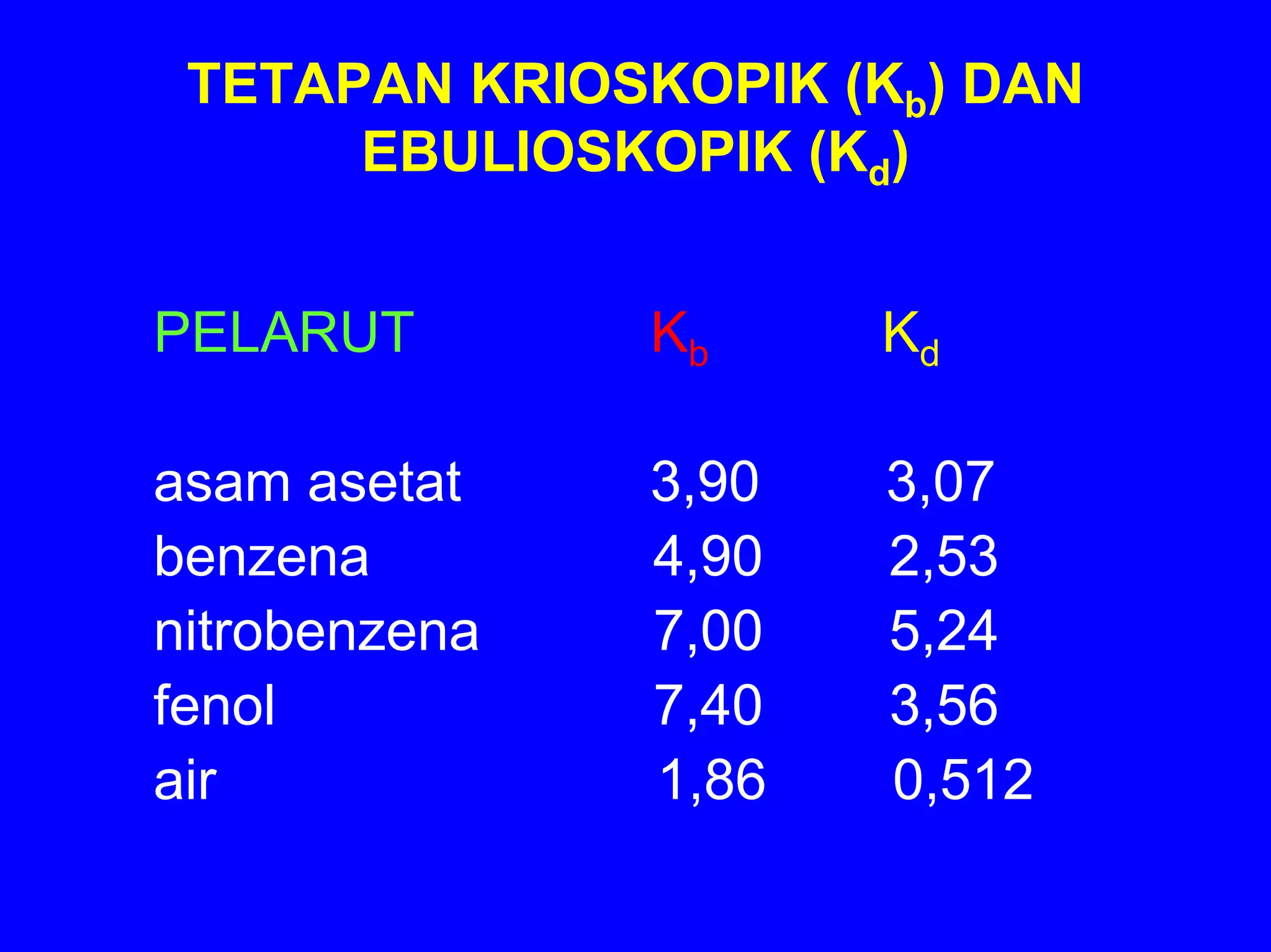
BAB 5 membahas konsep larutan, termasuk komposisi, sifat zat terlarut, kesetimbangan larutan, dan sifat koligatif larutan. Konsep-konsep kunci meliputi komposisi larutan (persen, molaritas, molalitas), sifat ionik dan molekuler zat terlarut, faktor yang mempengaruhi kelarutan, dan dampak zat terlarut terhadap sifat pelarut seperti tekanan uap, titik didih dan beku, s