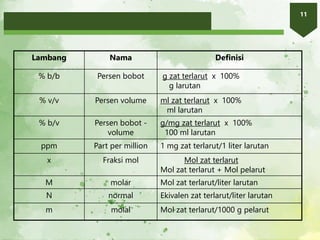
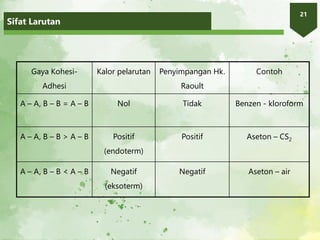
1. Dokumen membahas tentang larutan dan konsentrasi, termasuk definisi larutan, jenis larutan, hukum Raoult, dan sifat koligatif larutan.
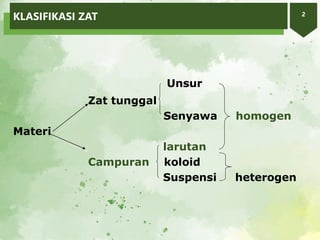
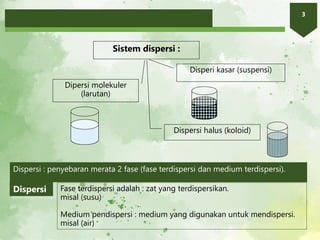
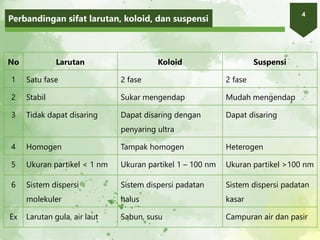
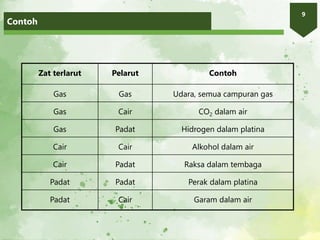
2. Larutan adalah campuran homogen yang terdiri atas zat terlarut dan pelarut. Kelarutan suatu zat bergantung pada sifat zat terlarut, pelarut, suhu, dan tekanan.
3. Hukum Raoult menyatakan bahwa tekanan uap parsial suatu komp