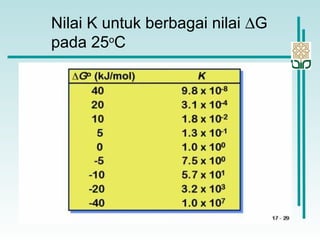
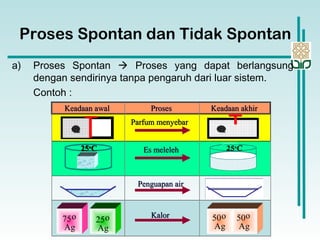
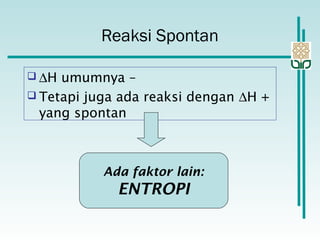
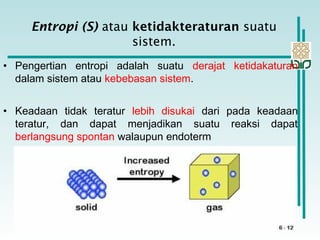
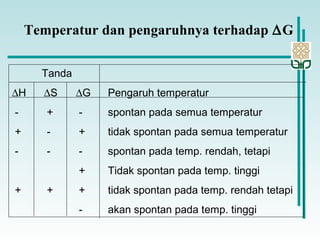
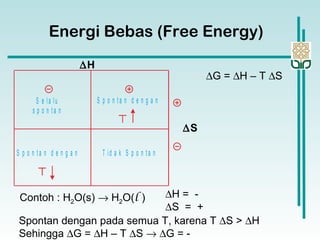
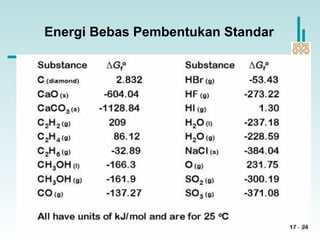
Dokumen membahas konsep termodinamika, khususnya hukum kedua yang menjelaskan mengenai proses spontan dan tidak spontan, beserta pengaruh entropi dan entalpi pada reaksi kimia. Proses spontan terjadi tanpa pengaruh luar dan sering diiringi penurunan entalpi, sementara entropi berkaitan dengan derajat ketidakteraturan sistem. Energi bebas Gibbs digunakan untuk menentukan spontanitas suatu reaksi dengan mengaitkan perubahan entalpi dan entropi pada suhu tertentu.







![Entropi (S) atau ketidakteraturan suatu
sistem.
Reaksi pada proses diatas
A(g) + B(g) (A + B)(g)
∆S = Scampuran(A+B) – [SA(g) + SB(g)]
Karena Scampuran(A+B) > [SA(g) + SB(g)], maka ∆S akan
bernilai +. Dapat disimpulkan bahwa ”Apabila ∆S
positif, maka reaksi akan berlangsung spontan”.](https://image.slidesharecdn.com/7-energibebasgibbs-140612231233-phpapp01/85/7-energi-bebas-gibbs-11-320.jpg)
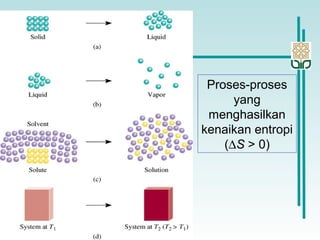
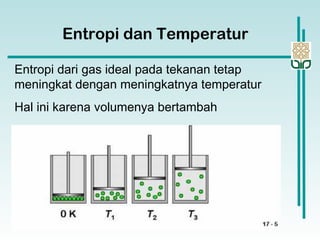
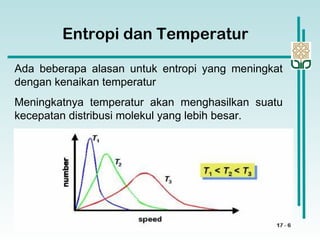

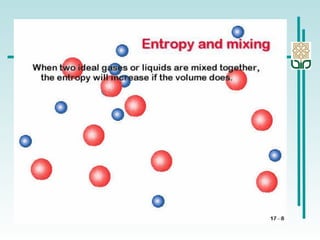

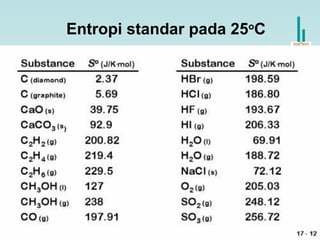
![Perubahan Entropi dalam suatu Sistem
(∆Ssis)
Entropi reaksi standar (∆S0
) adalah perubahan entropi
untuk reaksi yang terjadi pada 1 atm dan 250
C.
aA + bB cC + dD
∆S0
rxn dS0
(D)cS0
(C)= [ + ] - bS0
(B)aS0
(A)[ + ]
∆S0
rxn
nS0
(produk)= Σ mS0
(reaktan)Σ-
∆So
reaksi = ∆So
sistem
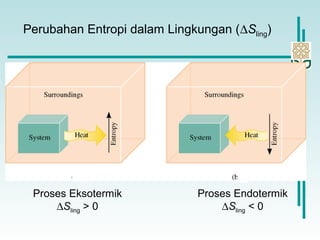
∆So
ling = - ∆H sis/T (pada tekanan konstan)](https://image.slidesharecdn.com/7-energibebasgibbs-140612231233-phpapp01/85/7-energi-bebas-gibbs-18-320.jpg)








![aA + bB cC + dD
∆G0
rxn d∆G0
(D)fc∆G0
(C)f= [ + ] - b∆G0
(B)fa∆G0
(A)f[ + ]
∆G0
rxn n∆G0
(produk)f= Σ m∆G0
(reaktan)fΣ-
Energi-bebas reaksi standar (∆G0
) adalah perubahan energi
bebas suatu reaksi pada kondisi-kondisi standar.
rxn
Energi bebas pembentukan
standar adalah perubahan
energi bebas yang terjadi ketika 1
mol senyawa terbentuk dari unsur-
unsurnya pada keadaan standar.
∆G0
dari semua unsur dalam
bentuk standarnya adalah nol.
f
(∆G0
)](https://image.slidesharecdn.com/7-energibebasgibbs-140612231233-phpapp01/85/7-energi-bebas-gibbs-32-320.jpg)
![2C6H6 (l) + 15O2 (g) 12CO2 (g) + 6H2O (l)
∆G0
rxn n∆G0
(produk)f= Σ m∆G0
(reaktan)fΣ-
Berapakah perubahan energi bebas standar untuk reaksi
di bawah ini pada 25 0
C?
∆G0
rxn 6∆G0
(H2O)f12∆G0
(CO2)f= [ + ] - 2∆G0
(C6H6)f[ ]
∆G0
rxn = [ 12x–394,4 + 6x–237,2 ] – [ 2x124,5 ] = -6405 kJ
Apakah reaksi di atas spontan pada 25 0
C?
∆G0
= -6405 kJ < 0
spontan](https://image.slidesharecdn.com/7-energibebasgibbs-140612231233-phpapp01/85/7-energi-bebas-gibbs-34-320.jpg)