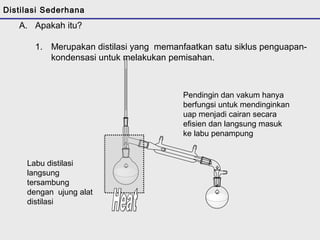
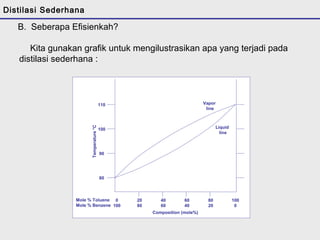
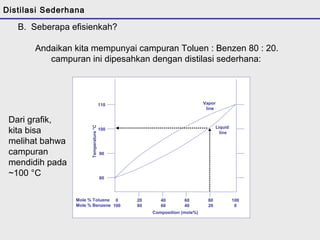
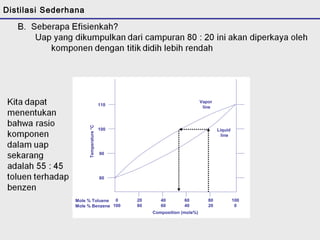
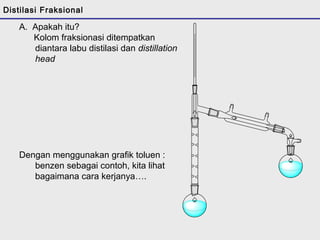
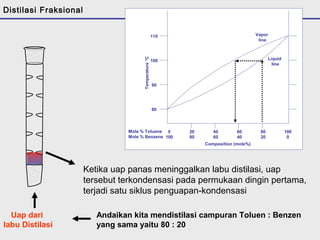
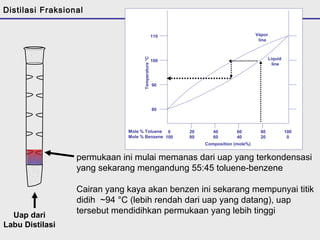
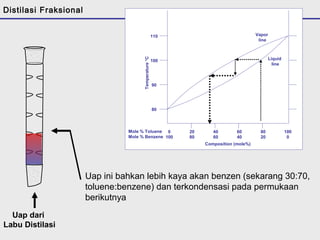
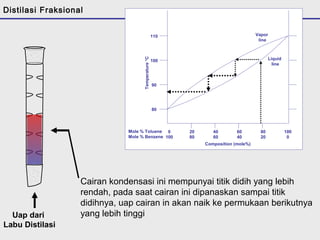
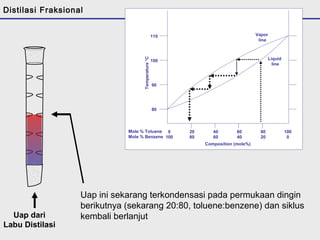
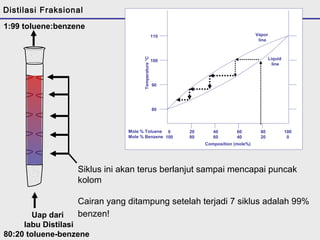
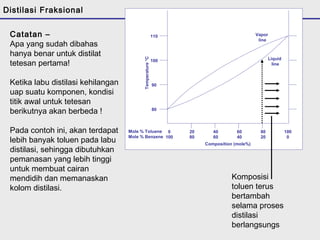
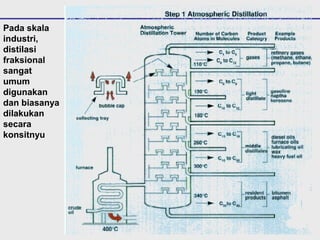
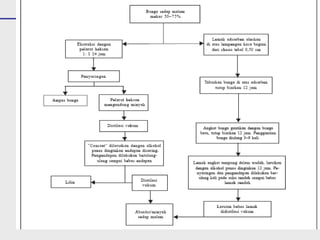
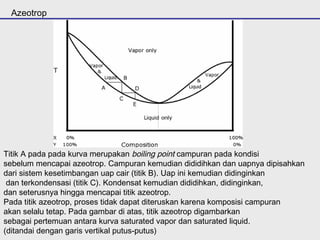
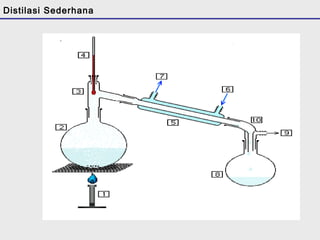
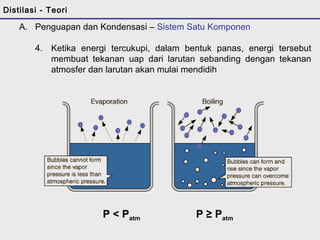
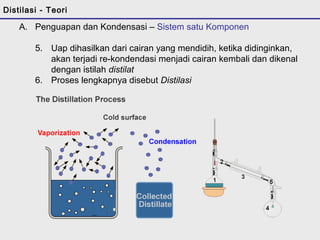
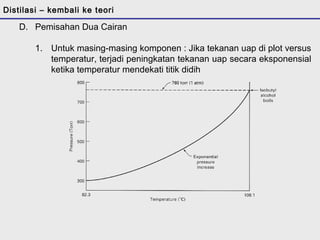
Distilasi adalah teknik pemisahan campuran berdasarkan perbedaan titik didih komponen. Distilasi memanfaatkan proses penguapan dan kondensasi untuk memisahkan komponen yang lebih mudah menguap dari yang lainnya. Distilasi sederhana hanya menggunakan satu siklus penguapan-kondensasi sehingga efisiensinya terbatas.







![Distilasi – Teori
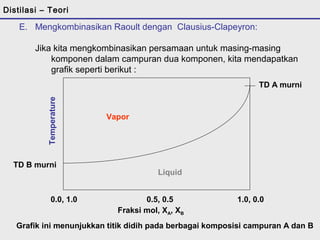
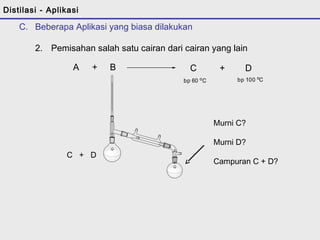
D. Pemisahan Dua Cairan
2. Hubungan antara tekanan uap vs temperatur dijelaskan oleh
persamaan Clausius-Clapeyron :
p = po exp [ - DH ]
R (1/T – 1/To)
x,y (independent dan dependent variabel) untuk persamaan ini
temperatur (T) yang diketahui dan tekanan uap (p) dihitung
berdasarkan temperatur tersebut.
Konstanta untuk persamaan ini :
po and To: Tekanan uap yang diketahui untuk temperatur
yang diketahui (°K)
DH: panas penguapan dari cairan
R: Konstanta gas (8.314 J . mol-1 . ° K)](https://image.slidesharecdn.com/distilasi-140928065635-phpapp01/85/Distilasi-15-320.jpg)




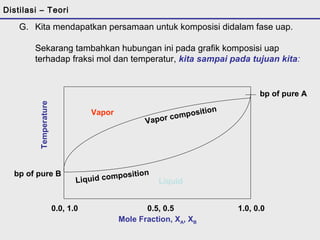
![E. Mengkombinasikan Raoult dan Clausius-Clapeyron:
4. Jika kita mensubstitusi persamaan :
Patm - PB
(PA - PB)
[- DH (1/T – 1/To) R ]
XA = __________
pada persamaan Clausius-Clapeyron :
p = po exp
Kita mendapatkan persamaan untuk fraksi mol dari masing-masing
komponen dalam cairan yang mendidih pada temperatur pengujian :
[ - DHB
Patm - P°exp R (1/T – 1/To
B) ]
XA = _________________________________________________________ B P°A exp[ (1/T – 1/To
A) - DHA
R ] P°B exp (1/T – 1/To
B) - DHB
R _ [ ]
Distilasi – Teori](https://image.slidesharecdn.com/distilasi-140928065635-phpapp01/85/Distilasi-21-320.jpg)