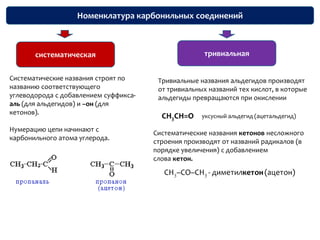
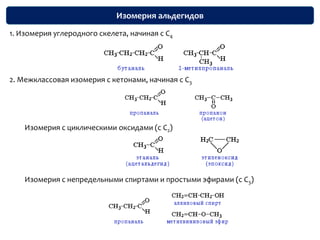
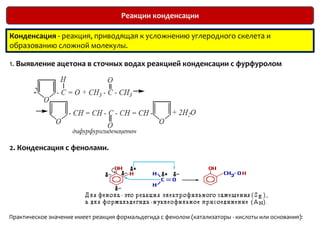
Документ описывает карбонильные соединения, такие как альдегиды и кетоны, их структуру, свойства и классификацию. Основное внимание уделяется реакциям, включая нуклеофильное присоединение, окисление и полимеризацию, а также методам их получения и применения в химической промышленности. Включены примеры качественных реакций для определения присутствия альдегидов и кетонов в различных системах.