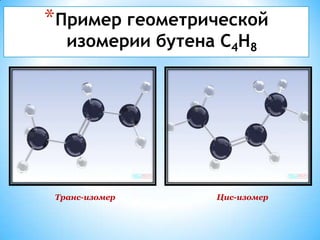
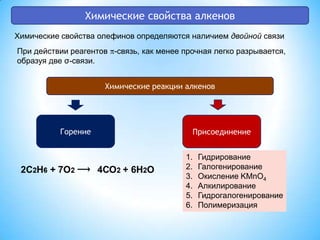
Документ описывает непредельные углеводороды, такие как алкены и алкины, отмечая их химические свойства, структурные и геометрические изомеры, а также способы синтеза (дегидратация спиртов, крекинг и другие). Алкены характеризуются двойными связями и имеют формулу CnH2n, тогда как алкины имеют тройные связи с общей формулой CnH2n-2. Документ также рассматривает механизмы реакций и применения этих углеводородов.




























![Реакции окисления алкиновАцетилен и его гомологи окисляются перманганатом калия срасщеплением тройной связи и образованием карбоновых кислот:RCCR’ + 3[O] + H2O RCOOH + R’COOHАлкины обесцвечивают раствор KMnO4 (качественная реакция)При сгорании (полном окислении) ацетилена выделяется большое количества тепла:HCCH + 2О2 2СО2 + Н2О + Q](https://image.slidesharecdn.com/random-110803042834-phpapp02/85/3-31-320.jpg)




