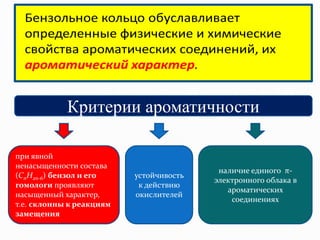
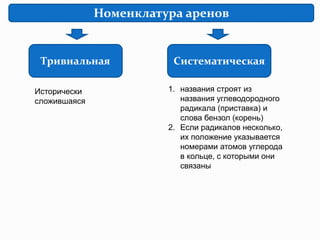
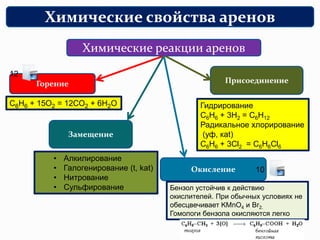
Ароматические соединения, или арены, представляют собой углеводороды с бензольным кольцом, характеризующиеся уникальными свойствами, такими как устойчивость к окислителям и склонность к реакциям замещения. Документ описывает критерии ароматичности, номенклатуру, изомерию и реакции, включая галогенирование и нитрование. Также рассматриваются физические и химические свойства аренов, их источники и методы получения.