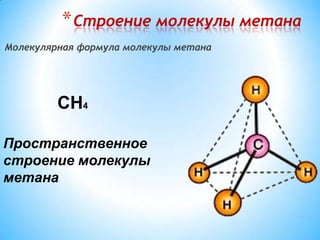
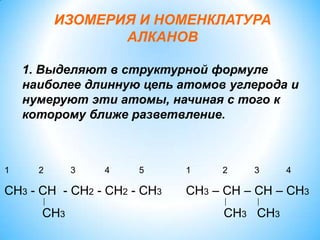
Алканы, или предельные углеводороды, характеризуются насыщенными молекулами с формулой CnH2n+2 и имеют особенности в номенклатуре и изомерии. Включает информацию о строительстве молекул, физических и химических свойствах, а также различных методах получения алканов. Используются в производстве сажи и органических веществ, включая растворители и хладогенты.