Документ посвящен галогенопроизводным, их структуре и свойствам, включая номенклатуру и изомерию. Обсуждаются методы синтеза, физические и химические свойства, а также механизмы реакций нуклеофильного замещения (SN1 и SN2). Кроме того, приводятся примеры реакций и их стереохимия.




















![СН 3 Br + :ОН – СН 3 ОН + :Br Рассмотрим теперь реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому спирту: ХИМИЧЕСКИЕ СВОЙСТВА R – X S N – РЕАКЦИЯ: МЕХАНИЗМ И КИНЕТИКА. ‒ Кинетические данные для этой реакции показывают, что скорость реакции в этом случае зависит от концентрации обоих реагентов и выражается кинетическим уравнением второго порядка: = К [НО: ֿ ][СН 3 Br ] Это бимолекулярное нуклеофильное замещение или S N 2 -реакция](https://image.slidesharecdn.com/13-15329-120111005327-phpapp02/85/slide-21-320.jpg)









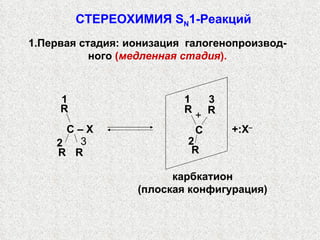










![ГАЛОГЕНОПРОИЗВОДНЫЕ В решающей стадии реакции участвуют оба реагента и НО : – и СН 3 Br , следовательно скорость реакции должна быть пропорциональна концентрации обоих реагентов: = К [НО: ֿ ][СН 3 Br ] (кинетическое уравнение второго порядка) Эксперименты показывают, что это действительно так, т. е. SN 2 – реакция имеет второй порядок.](https://image.slidesharecdn.com/13-15329-120111005327-phpapp02/85/slide-42-320.jpg)




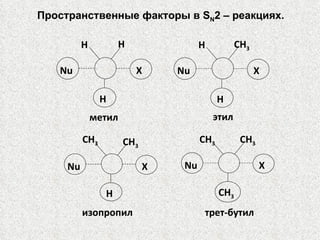














![ГАЛОГЕНОПРОИЗВОДНЫЕ Из этого правила следует: сильные основания обычно бывают плохими уходящими группами; слабые основания обычно являются хорошими уходящими группами, т. е. [Существует обратное соотношение между основностью частицы и ее способностью быть уходящей группой.] основность растет: F – , Cl – , Br – , I – способность быть уходящей группой растет:](https://image.slidesharecdn.com/13-15329-120111005327-phpapp02/85/slide-62-320.jpg)






![ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные вещества: Примеры : поливинилхлорид винилхлорид 1. nCH 2 =CHCI [–CH 2 –CHCI –] n 2. nCF 2 =CF 2 [–CF 2 –CF 2 –] n тетрафторэтилен тефлон фторэтен поливинилфторид 3. nCH 2 =CHF [–CH 2 –CHF –] n](https://image.slidesharecdn.com/13-15329-120111005327-phpapp02/85/slide-69-320.jpg)
![ГАЛОГЕНОПРОИЗВОДНЫЕ 4. nCH 2 =CF 2 [–CH 2 –CF 2 –] n 1,1-дифторэтан поливинилиденфторид 1,1,2-трифтор-2-хлорэтен политрифтор-хлорэтилен 5. nCF 2 = CFCI [– CF 2 – CFCI –] n Фреоны ( CF 2 CI 2 )– галогеналканы, фторсодержащие производные насыщенных углеводо-родов, используемые как хладагенты. Это бесцветные газы или жидкости, без характерного запаха, очень инертны, не горят в воздухе,взрывобезопасны.](https://image.slidesharecdn.com/13-15329-120111005327-phpapp02/85/slide-70-320.jpg)