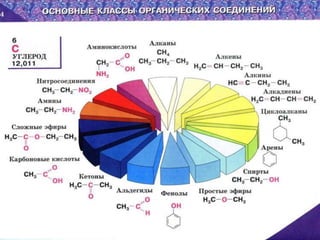
Документ представляет основные положения органической химии, включая теорию строения химических соединений, выдвинутую А. М. Бутлеровым, и ее влияние на объяснение изомерии, гомологии и свойства органических веществ. Рассматриваются электронные конструкции атома углерода, механизмы химических реакций и типы реакций, характерные для различных классов органических соединений. Документ также включает примеры задач, касающихся характеристик и механизмов химических реакций.