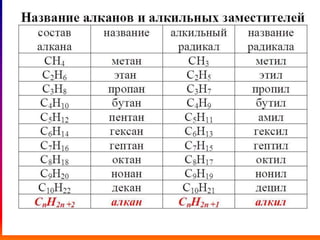
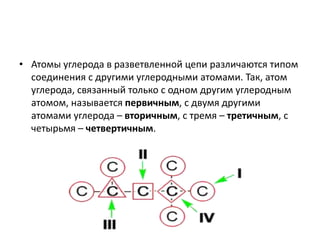
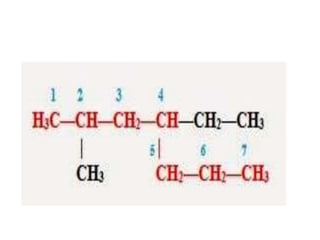
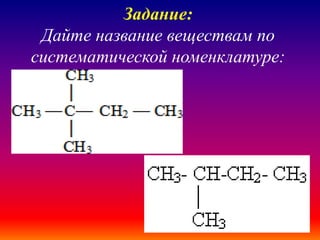
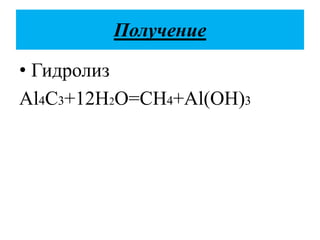
Документ описывает алканы как предельные углеводороды с простой связью между атомами углерода и hybridization sp3. Рассматриваются их физические и химические свойства, включая реакции горения и замещения. Также представлены номенклатура алканов и примеры изомерии.