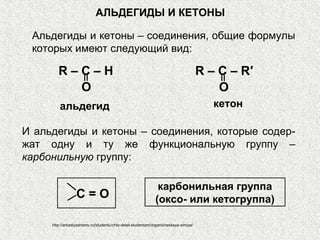
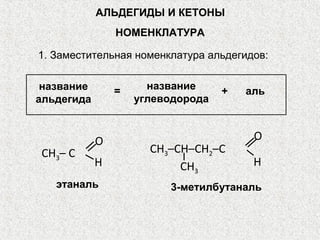
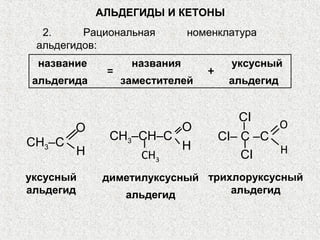
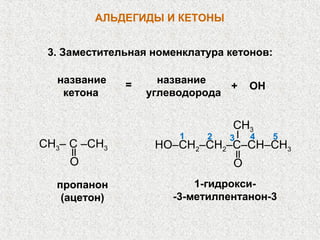
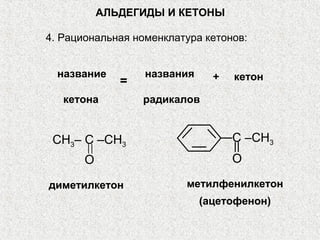
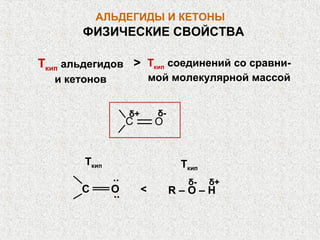
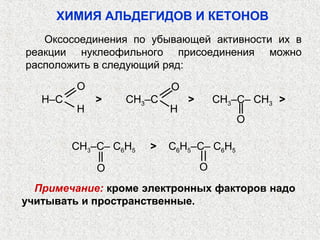
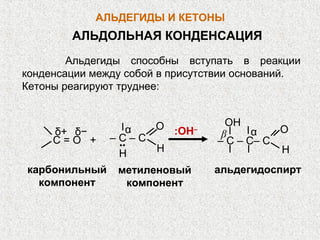
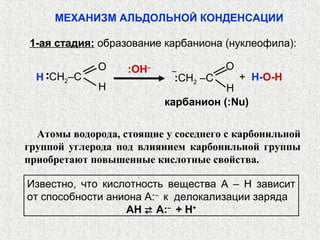
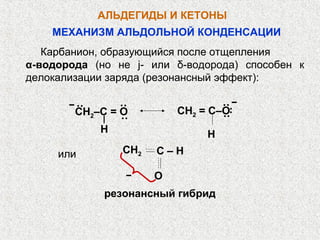
Альдегиды и кетоны – это карбонильные соединения с одинаковой функциональной группой, обладающие очевидной изомерией и специфической номенклатурой. Их химические и физические свойства определяются полярностью карбонильной группы, площадью атаки для нуклеофилов и способностью образовывать водородные связи. Реакции альдегидов и кетонов включают нуклеофильное присоединение, окисление и восстановление, с возможностью получения различных производных.












![АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ
4. Присоединение (СО + Н2) к алкенам:
O
CO + H2 R–CH–C
R–CH=CH2 +
[Co(CO)4]2, t0,P H
CH3
O
+ R–CH2–CH2–C
H
5. Гидролиз дигалогенопроизводных:
CI OH O
HOH -H2O
R–C–CI R–C–OH R–C
гидролиз H
Н H
альдегид](https://image.slidesharecdn.com/20-21-121206091520-phpapp02/85/20-21-19-320.jpg)

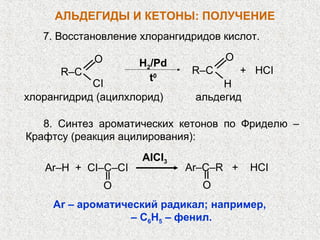






![РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ.
ПРИМЕРЫ
1. Присоединение водорода с образованием спиртов:
O 2Н
R–C R–CH2–OH
H
альдегид первичный спирт
O 2Н
R–C R– CH –R′
R′ OH
кетон вторичный спирт
Эффективными восстановителями являются гидриды
металлов: Li[AlH4], Na[BH4], где роль Nu: играет :H−](https://image.slidesharecdn.com/20-21-121206091520-phpapp02/85/20-21-30-320.jpg)















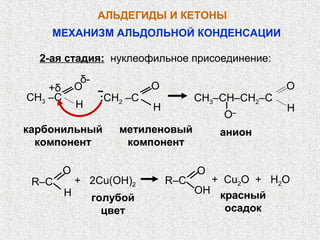


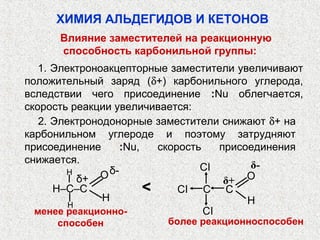
![ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
Альдегиды окисляются легко слабыми окислителями:
[Ag(NH3)2]OH и Cu(OH)2
РЕАКЦИЯ СЕРЕБРЯНОГО ЗЕРКАЛА
O O
+
R–C + 2[Ag(NH3)2] R–C + 2Ag↓+ 4NH3+ H2O
H OH
альдегид кислота](https://image.slidesharecdn.com/20-21-121206091520-phpapp02/85/20-21-52-320.jpg)

