Recommended
PDF
สมบัติตามหมู่และตามคาบของสาร
PDF
บทที่ 1 อะตอมและตารางธาตุ
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PPTX
PDF
PDF
แผนการจัดการเรียนรู้ที่ 9 อนุภาคในอะตอม.pdf
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PPTX
PDF
PDF
ชีทสรุป ม.4 เทอม 2 โดยครูเนยวิภา.pdf
PDF
PDF
PDF
กล้องจุลทรรศน์ (Microscope)
PDF
บทที่ 1 พันธุกรรมกับหมู่เลือด
PDF
โลก ดาราศาสตร์ อวกาศ ม.4 เล่ม 1_บทที่ 1 โครงสร้างโลก
PPTX
ความร้อนกับการเปลี่ยนแปลงอุณหภูมิของสสาร
PDF
PDF
PDF
PPTX
บทวิเคราะห์ร่ายยาวเวสสันดรมหาชาดก กัณฑ์มัทรี
PDF
PDF
PPTX
PPTX
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
กระบวนการถ่ายทอดลักษณะทางพันธุกรรม
PDF
PDF
ธาตุและสารประกอบ (elements and compound)
PDF
More Related Content
PDF
สมบัติตามหมู่และตามคาบของสาร
PDF
บทที่ 1 อะตอมและตารางธาตุ
PDF
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PPTX
PDF
PDF
แผนการจัดการเรียนรู้ที่ 9 อนุภาคในอะตอม.pdf
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
What's hot
PPTX
PDF
PDF
ชีทสรุป ม.4 เทอม 2 โดยครูเนยวิภา.pdf
PDF
PDF
PDF
กล้องจุลทรรศน์ (Microscope)
PDF
บทที่ 1 พันธุกรรมกับหมู่เลือด
PDF
โลก ดาราศาสตร์ อวกาศ ม.4 เล่ม 1_บทที่ 1 โครงสร้างโลก
PPTX
ความร้อนกับการเปลี่ยนแปลงอุณหภูมิของสสาร
PDF
PDF
PDF
PPTX
บทวิเคราะห์ร่ายยาวเวสสันดรมหาชาดก กัณฑ์มัทรี
PDF
PDF
PPTX
PPTX
PDF
บทที่ 20 ฟิสิกส์นิวเคลียร์ แก้ไขครั้งที่ 1
PDF
กระบวนการถ่ายทอดลักษณะทางพันธุกรรม
PDF
Similar to สมบัติของธาตุตามหมู่และตามคาบ
PDF
ธาตุและสารประกอบ (elements and compound)
PDF
PDF
PDF
PPT
PDF
PDF
PDF
พันธะเคมี-(Chemical Bonding)มทร.ล้านนา.pdf
PPT
PDF
PPT
PDF
PPT
PDF
โครงสร้างอะตอม.pdfวยกสยบปานสรรรเคารจผงบวแสสารแ
PPT
PPT
PPT
PDF
ตารางธาตุ_20240101256512345678900000.pdf
PPTX
โครงสร้างอะตอมและตารางธาตุ (โครงงานคอมพิวเตอร์)
PDF
More from พัน พัน
PDF
PDF
PDF
PDF
รายงานเทคโนโลยีคอมพิวเตอร์
PDF
PDF
PDF
เครือข่ายคอมพิวเตอร์เบื้องต้น
PDF
ประวัติความเป็นมาของคอมพิวเตอร์
PDF
เรื่องคอมพิวเตอร์เบื้องต้น
PDF
ระบบคอมพิวเตอร์และยุคสมัย
PDF
การทำงานพื้นฐานของคอมพิวเตอร์
PDF
PDF
PDF
หลักการทำงาน บทบาทและอุปกรณ์พื้นฐานของคอมพิวเตอร์
PDF
PDF
PDF
DOCX
การเปลี่ยนตัวเลขให้เป็นตัวอักษร
PDF
PDF
สมบัติของธาตุตามหมู่และตามคาบ 1. 2. 3. 4. ขนาดอะตอม (Atomic Radius)
การบอกขนาดอะตอม จะบอกด้วย “รัศมีอะตอม”
โดยจะแบ่งประเภทของรัศมีอะตอมดังนี้
รัศมีโคเวเลนต์(Covalent radius)
รัศมีแวนเดอร์วาลส์(Van derWaals radius)
รัศมีโลหะ (Matallicradius) 5. ขนาดอะตอม (Atomic Radius)
รัศมีโคเวเลนต์คือระยะทางครึ่งหนึ่งของความ ยาวพันธะโคเวเลนต์ ระหว่างอะตอมชนิดเดียวกัน ตัวอย่างรัศมีโคเวเลนต์ของไฮโดรเจนและคลอรีนแสดงได้ ดังนี้
ความยาวพันธะ H –H =74pm
รัศมีโคเวเลนต์ของ H=74/2pm
= 37pm
รัศมีโคเวเลนต์ เป็นแรงยึดเหนี่ยวระหว่างอะตอมคู่ หนึ่ง ระหว่างอโลหะกับอโลหะ ซึ่งเกิดจากการใช้ อิเล็กตรอนร่วมกัน และระยะระหว่างนิวเคลียสของ อะตอมคู่ที่สร้างพันธะโคเวเลนต์ต่อกันจะเรียกว่า ความยาวพันธะ 6. 7. ขนาดอะตอม (Atomic Radius)
กรณีที่เป็นพันธะโคเวเลนต์ระหว่างอะตอมต่างชนิดกัน เช่น CCl4อาจ หารัศมีอะตอมของธาตุคาร์บอนได้ เมื่อทราบความยาวพันธะระหว่างอะตอม ของธาตุทั้งสอง ตัวอย่างเช่น
จากข้อมูลทราบว่า ความยาวพันธะ C –Cl =176 pm
รัศมีอะตอมของ Cl = 99 pm
ดังนั้น รัศมีอะตอมของ C= (176 -99)
= 77 pm 8. ขนาดอะตอม (Atomic Radius)
รัศมีแวนเดอร์วาลส์ คือระยะทางครึ่งหนึ่งของ ระยะระหว่างนิวเคลียสของอะตอมที่อยู่ใกล้ที่สุด ตัวอย่าง รัศมีแวนเดอร์วาลส์ซึ่งหาได้จากอะตอมของแก๊สเฉื่อย 9. ขนาดอะตอม (Atomic Radius)
รัศมีโลหะ คือ ระยะทางครึ่งหนึ่งของระยะระหว่าง นิวเคลียสของอะตอมโลหะที่อยู่ใกล้ที่สุด เช่น ธาตุ แมกนีเซียม มีระยะระหว่างนิวเคลียสของอะตอมสอง
อะตอมอยู่ใกล้กันที่สุด 10. ขนาดอะตอม (Atomic Radius)
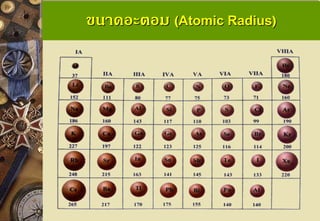
ปัจจัยที่มีผลต่อขนาดของอะตอมและขนาดไอออน จานวนระดับพลังงาน ถ้ามีจานวนระดับพลังงานมากขึ้น ขนาดของ ของอะตอมจะใหญ่มากขึ้นตามไปด้วย จานวนโปรตอน ในกรณีที่มีจานวนระดับพลังงานเท่ากัน ให้พิจาณา จานวนโปรตอน ถ้ามีโปรตอนมาก อะตอมจะมีขนาดเล็กว่า อัตราส่วนระหว่างโปรตอนกับอิเล็กตรอน ไอออนของธาตุ ถ้ามี โปรตอน/อิเล็กตรอนมาก ไอออนนั้นก็จะมีขนาดเล็กลง 11. ขนาดอะตอม (Atomic Radius) แนวโน้มขนาดอะตอมในหมู่เดียวกัน
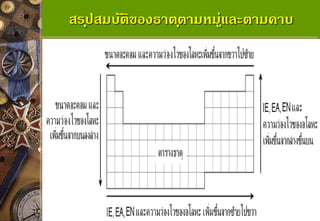
ธาตุในหมู่เดียวเดียวกันขนาดอะตอมจะใหญ่ขึ้น จากบนลงล่าง เนื่องจากธาตุในหมู่เดียวกันจะมีเลข อะตอมเพิ่มขึ้นจากบนลงล่าง เมื่อเลขอะตอมเพิ่มขึ้นจะ ทาให้มีจานวนระดับชั้นพลังงานเพิ่มมากขึ้น จึงทาให้มี ขนาดอะตอมเพิ่มขึ้นตามลาดับ 12. ขนาดอะตอม (Atomic Radius) แนวโน้มขนาดอะตอมในคาบเดียวกัน
ธาตุในคาบเดียวกันจะมีขนาดอะตอมเล็กลงจากซ้ายไป ขวา เพราะธาตุที่อยู่ในคาบเดียวกัน จะมีระดับชั้นพลังงานเท่ากัน แต่เลขอะตอม (โปรตอน) จะเพิ่มขึ้นจากซ้ายไปขวา ทาให้มีแรง ดึงดูดอิเล็กตรอนมากยิ่งขึ้น จึงทาให้มีขนาดอะตอมเล็กลง 13. 14. 15. ขนาดไอออน (Ionic Radius)
ไอออน คือ อะตอมหรือกลุ่มอะตอมที่มีประจุไฟฟ้า ซึ่งจะมีประจุ ไฟฟ้าบวกหรือลบเท่านั้น โดยแบ่งไอออน ออกเป็น 2 ประเภท คือ
ไอออนบวก เกิดจากที่อะตอมหรือกลุ่มอะตอมเกิดการสูญเสีย อิเล็กตรอน จึงทาให้มีจานวนโปรตอนมากกว่าอิเล็กตรอน จึงแสดงประจุ บวกออกมา
ไอออนลบ คือ เกิดจากอะตอมหรือกลุ่มอะตอมได้รับอิเล็กตรอน จากอะตอมอื่น จึงทาให้มีจานวนอิเล็กตรอนมากกว่าโปรตอน จึงแสดง ประจุลบออกมา
สิ่งที่ใช้พิจารณาขนาดของไอออน คือ รัศมีไอออน ซึ่งเป็นระยะห่าง ระหว่างนิวเคลียสของไอออนบวกและไอออนลบ (พันธะไอออนิก) 16. 17. ขนาดไอออน (Ionic Radius)
ไอออนในหมู่เดียวกันจะมีขนาดใหญ่ขึ้นจากบนลงล่าง เนื่องจาก จานวนระดับชั้นพลังงานเพิ่มขึ้นจากบนลงล่าง แนวโน้มขนาดไอออนในหมู่เดียวกัน
ไอออนหมู่ 1
จานวนระดับชั้นพลังงาน
2
2 8
2 8 8
2 8 18 8
2 8 18 18 8 18. ขนาดไอออน (Ionic Radius)
ไอออนในคาบเดียวกันจะแบ่งออกเป็น 2 ประเภท คือ ไอออนบวก ที่มาจากโลหะ และไอออนลบที่มาจากอโลหะ แนวโน้มของขนาดไอออน ตามคาบจะเล็กลงจากซ้ายไปขวา โดยมีขนาดใหญ่ขึ้นเมื่อถึงไอออนลบ จากนั้นก็จะมีขนาดเล็กลงจากซ้ายไปขวาเช่นเดิม แนวโน้มขนาดไอออนในคาบเดียวกัน 19. ขนาดไอออน (Ionic Radius) การเปรียบเทียบระหว่างไอออนบวกกับไอออนลบ
Mg : 1s22s22p63s2
160 pm
Mg2+: 1s22s22p6
65 pm
O : 1s22s22p4
73 pm
O2-: 1s22s22p6
140 pm 20. 21. 22. พลังงานไอออไนเซชัน (Ionization energy)
พลังงานไอออนไนเซชัน (IE) คือ พลังงานน้อยที่สุดที่ทาให้ อิเล็กตรอนหลุดออกจากอะตอมหรือไอออนที่อยู่ในสภาวะแก๊ส
พลังงานที่ใช้ในการดึง e-หลุดออกจากในสภาวะก๊าซ
อะตอมใดมีขนาดเล็ก จะทาให้ดึง e-ออกยาก IE สูง
อะตอมใดมีขนาดใหญ่ จะทาให้ดึง e-ออกง่าย IE ต่า 23. พลังงานไอออไนเซชัน (Ionization energy)
พลังงานไอออไนเซชันลาดับที่หนึ่ง(IE1) เป็นพลังงานที่ต้องใช้ในการดึง อิเล็กตรอนตัวแรกออกจากอะตอมอิสระในสถานะแก๊ส
Na(g)Na+(g)+ e-
พลังงานไอออไนเซชันลาดับที่สอง(IE2) เป็นพลังงานที่ต้องใช้ในการดึง
อิเล็กตรอนออกจากไอออนที่มีประจุ +1 ในสถานะแก๊ส
Na+(g)Na2+(g)+ e-
ค่าพลังงานไอออไนเซชันสูงแสดงว่าการดึงอิเล็กตรอนออกไปทาได้ยาก 24. พลังงานไอออไนเซชัน (Ionization energy)
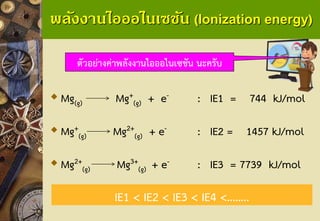
Mg(g)Mg+ (g)+ e-: IE1 = 744 kJ/mol
Mg+ (g)Mg2+ (g)+ e-: IE2 = 1457 kJ/mol
Mg2+ (g)Mg3+ (g) + e-: IE3 = 7739 kJ/mol
ตัวอย่างค่าพลังงานไอออไนเซชัน นะครับ
IE1 < IE2 < IE3 < IE4 <…….. 25. พลังงานไอออไนเซชัน (Ionization energy)
M (g)+ IE1M+(g)+ e-เมื่อ IE1 คือ พลังงานไอออไนเซชันลาดับที่ 1
M+(g)+ IE2M2+(g)+ e-เมื่อ IE2 คือ พลังงานไอออไนเซชันลาดับที่ 2
M2+(g)+ IE3M3+(g)+ e-เมื่อ IE3 คือ พลังงานไอออไนเซชันลาดับที่ 3
M3+(g)+ IE4M4+(g)+ e-เมื่อ IE4 คือ พลังงานไอออไนเซชันลาดับที่ 4
M4+(g)+ IE5M5+(g)+ e-เมื่อ IE5 คือ พลังงานไอออไนเซชันลาดับที่ 5
M5+(g)+ IE6M6+(g)+ e-เมื่อ IE6 คือ พลังงานไอออไนเซชันลาดับที่ 6 26. 27. พลังงานไอออไนเซชัน (Ionization energy)
แนวโน้มของพลังงานไอออไนเซชันตามหมู่
ค่าพลังงานไอออไนเซชันจะลดลงจากบนลงล่าง โดยพิจารณาจากขนาดของ อะตอม เมื่อพิจารณาจากบนลงล่าง ขนาดของอะตอมจะมีใหญ่ขึ้น จึงทาให้อิเล็กตรอน สามารถหลุดออกได้ง่าย จึงทาให้ใช้พลังงานน้อยลง
แนวโน้มของพลังงานไอออไนเซชันตามคาบ
พลังงานไอออไนเซชันจะเพิ่มขึ้นจากซ้ายไปขวา โดยพิจารณาตาม
ขนาดของอะตอม เพราะถ้าอะตอมมีขนาดใหญ่จะทาให้แรงดึงดูดจากโปรตอนน้อย จึง ทาให้อิเล็กตรอนสามารถหลุดออกได้ง่าย แต่ในขณะเดียวกันเมื่อพิจารณาขนาด อะตอมของซ้ายไปขวา จะมีขนาดเล็กลง จึงทาให้อิเล็กตรอนหลุดออกได้ยาก จึงทาให้ ต้องใช้พลังงานมากขึ้นในการที่จะดึงอิเล็กตรอนหลุดออก 28. พลังงานไอออไนเซชัน (Ionization energy)
จากการเปรียบเทียบค่า IEข้างต้นจะสังเกตได้ว่าค่า IE จะ แปรผกผันกับขนาดอะตอม อย่างไรก็ตามเมื่อพิจารณาค่า IE อย่าง ละเอียดพบว่าภายในคาบหนึ่งๆ จะมีข้อยกเว้นอยู่ดังแสดงในรูปที่ 3.18 พบว่าอะตอม Be มีขนาดใหญ่กว่า B แต่ว่า IE1 ของ Be สูง กว่า IE1 ของ B เช่นเดียวกับอะตอม N ที่มีขนาดใหญ่กว่า O แต่ ว่า IE1 ของ N สูงกว่า IE1 ของ O 29. First Ionization Energy Plot
5
10
15
20
25
30
35
40
Atomic number
First ionization energy (kJ/mol)
0
500
1000
1500
2000
2500
H
He
Li
Be
B
C
N
O
F
Ne
Mg
Na
Al
Si
P
S
Cl
Ar
Ca
K
Sc
Ti
V
Cr
Mn
Fe
Co
Cu
Ni
Zn
Ga
Ge
As
Se
Br
Rb
Sr
Kr
แนวโน้มค่า IE1 ของธาตุในตารางธาตุ 30. 31. พลังงานไอออไนเซชัน (Ionization energy)
พลังงานไอออไนเซชันในแต่ละธาตุ จะมีค่าสูงเพิ่มขึ้นมาก เมื่อเกี่ยว ข้องกับการดึงอิเล็กตรอนออกจากสภาวะที่มีการจัดเรียงอิเล็กตรอนคล้าย แก๊สมีตระกูล (inner-pair effect) 32. พลังงานไอออไนเซชัน (Ionization energy)
First Ionization Energy เพิ่มขึ้น
First Ionization Energy เพิ่มขึ้น
ตามหมู่ ระดับพลังงาน มากขึ้น
e-อยู่ไกล Nu มาก
e-หลุดง่าย
IE ต่า
ตามคาบ จานวนประจุบวกเพิ่มมากขึ้น e-ถูกดึงดูดมาอยู่ใกล้ Nu ได้มากe-หลุดยาก IE สูง 33. 34. พลังงานไอออไนเซชัน (Ionization energy)
ธาตุ X มีค่าพลังงานไอออไนเซชัน ดังต่อไปนี้ตามลาดับ จงหาว่าธาตุ Xเป็นธาตุหมู่ใด
495.9, 4560, 6900, 9540, 13400, 16600,
20120, 25490, 28390, 141360 ,170000
หมู่ 1เพราะพลังงานกลุ่มที่น้อยที่สุดที่ใช้ดึงอิเล็กตรอนกลุ่ม แรกมีเพียงค่าเดียว
ธาตุ X มีค่าพลังงานไอออไนเซชัน ดังต่อไปนี้ตามลาดับ จงหา ว่าธาตุ Xเป็นธาตุคาบใด 35. พลังงานไอออไนเซชัน (Ionization energy)
495.9 , 4560 , 6900 , 9540 , 13400 , 16600,20120 , 25490 , 28390 ,141360, 170000
Y
Z
6560 , 7900 , 11540 , 14400 , 17600,21920 , 29690, 241760 ,270000
เหตุใดอิเล็กตรอนตัวแรกของ Z จึงต้องใช้พลังงานสูงกว่า Y 36. พลังงานไอออไนเซชัน (Ionization energy)
495.9 , 4560 , 6900 , 9540 , 13400 , 16600,20120 , 25490 , 28390 ,141360, 170000
Y
Z
6560 , 7900 , 11540 , 14400 , 17600, 21920 , 29690, 241760 ,270000
Y
Z 37. 38. อิเล็กโทรเนกาติวิตี (Electronegativity; EN)
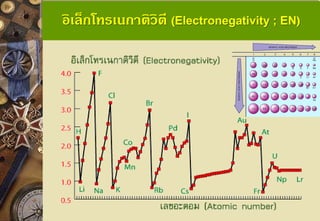
อิเล็กโทรเนกาติวิตี (Electronegativity หรือ EN) คือ เป็นค่า แสดงความสามารถในการดึงดูดอิเล็กตรอนคู่ร่วมพันธะจาก Nucleus
e-คู่ร่วมพันธะของอะตอมที่มีขนาดเล็ก จะได้รับแรงดึงดูดจาก Nucleus มาก EN สูง
e-คู่ร่วมพันธะของอะตอมที่มีขนาดใหญ่ จะได้รับแรงดึงดูดจาก
Nucleus น้อย EN ต่า
อะตอมที่มีสภาพไฟฟ้าลบมาก จะดึงอิเล็กตรอนที่ใช้ร่วมกันในการเกิด พันธะโคเวเลนต์เข้าหาตัวเองได้มากกว่า ได้มีผู้หาค่าสภาพไฟฟ้าลบไว้หลาย แบบ แต่ที่นิยมใช้อ้างอิงมากที่สุด คือ ของพอลิง โดยกาหนดให้ฟลูออรีนมี ค่าสภาพไฟฟ้าลบมากที่สุด คือ เท่ากับ 4.0และซีเซียม (Cs) มีสภาพไฟฟ้า ลบน้อยที่สุด คือเท่ากับ 0.7 39. อิเล็กโทรเนกาติวิตี (Electronegativity; EN)
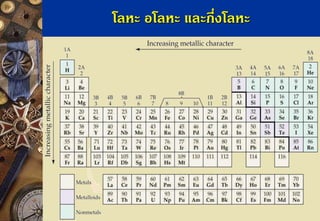
ธาตุหมู่เดียวกัน ค่า ENจะลดลงจากบนลงล่าง เพราะขนาด อะตอมใหญ่ขึ้นทาให้นิวเคลียสมีโอกาสดึงดูดอิเล็กตรอนได้น้อยกว่าอะตอม ที่มีขนาดเล็กENจึงต่าลง แนวโน้มของค่าอิเล็กโทรเนกาติวิตีในหมู่เดียวกัน แนวโน้มของค่าอิเล็กโทรเนกาติวิตีในคาบเดียวกัน
ธาตุในคาบเดียวกัน ค่า EN จะเพิ่มขึ้นจากซ้ายไปขวาเพราะ ขนาดอะตอมเล็กลงทาให้ได้รับแรงดึงดูดจากนิวเคลียสมากกว่าอะตอมที่มี ขนาดใหญ่ EN จึงสูงขึ้น 40. 41. 42. 43. 44. สัมพรรคภาพอิเล็กตรอน (Electron Affinity)
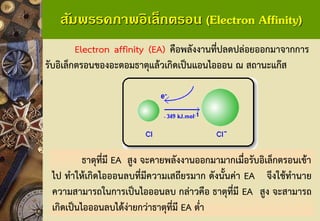
Electron affinity(EA)คือพลังงานที่ปลดปล่อยออกมาจากการ รับอิเล็กตรอนของอะตอมธาตุแล้วเกิดเป็นแอนไอออนณสถานะแก๊ส
ธาตุที่มี EA สูง จะคายพลังงานออกมามากเมื่อรับอิเล็กตรอนเข้า ไป ทาให้เกิดไอออนลบที่มีความเสถียรมาก ดังนั้นค่า EA จึงใช้ทานาย ความสามารถในการเป็นไอออนลบ กล่าวคือ ธาตุที่มี EA สูง จะสามารถ เกิดเป็นไอออนลบได้ง่ายกว่าธาตุที่มี EA ต่า 45. 46. สัมพรรคภาพอิเล็กตรอน (Electron Affinity)
สัมพรรคภาพอิเล็กตรอนจะตรงข้ามกับพลังงานไอออไนเซชัน
สัมพรรคภาพอิเล็กตรอนเป็นพลังงานที่เกิดขึ้นเมื่ออะตอม ในสถานะแก๊สรับอิเล็กตรอนเกิดเป็นไอออนที่มีประจุ -1ในสภาพที่เป็นแก๊ส:
Cl(g)+ e-Cl-(g)
สัมพรรคภาพอิเล็กตรอนสามารถเป็นได้ทั้งการคายพลังงาน หรือเป็นการดูดพลังงาน เช่น 47. สัมพรรคภาพอิเล็กตรอน (Electron Affinity)
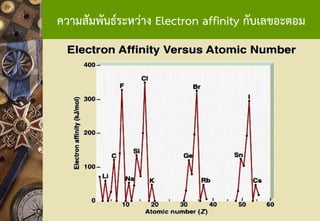
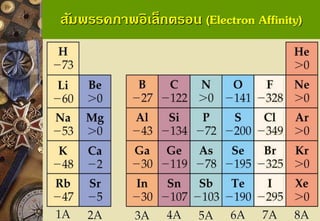
แนวโน้มสัมพรรคภาพอิเล็กตรอนตามหมู่
ธาตุในหมู่เดียวกันค่า EAลดลงจากบนลงล่าง เพราะธาตุข้างบนมี ขนาดเล็กกว่าธาตุข้างล่าง จึงมีแรงดึงดูดระหว่างประจุบวกที่นิวเคลียสกับ อิเล็กตรอนที่เพิ่มเข้าในอะตอมได้มากกว่า ระยะทางจากนิวเคลียสถึง ขอบเขตของอะตอมสั้นกว่าอะตอมที่มีขนาดใหญ่ที่อยู่ข้างล่างของหมู่ ธาตุ ข้างบนรับอิเล็กตรอนได้ดีกว่าธาตุข้างล่าง EA จึงมากกว่า 48. สัมพรรคภาพอิเล็กตรอน (Electron Affinity)
แนวโน้มสัมพรรคภาพอิเล็กตรอนตามคาบ
ธาตุในคาบเดียวกันค่า EA เพิ่มขึ้นจากซ้ายไปขวาของตารางธาตุ เพราะธาตุทางขวามีขนาดเล็กกว่าธาตุทางซ้าย จึงรับ e-ได้ดีกว่า e-ที่เข้า มาใหม่จะถูกดึงดูดด้วย Nucleus ได้มากกว่า EA จึงมากกว่า
* Li or Na* O or F 49. 50. 51. 52. 53. 54. 55. 56. 57. จุดเดือดและจุดหลอมเหลวของโลหะ
ก. โลหะในหมู่เดียวกัน คือ หมู่ IA , IIA, และ IIIA “จุดหลอมเหลว และจุดเดือดมีแนวโน้มลดลง เมื่อเลขอะตอมเพิ่มขึ้น” เนื่องจากความ แข็งแรงของพันธะโลหะลดลง เพราะมีขนาดอะตอมใหญ่ขึ้น
ข. โลหะในคาบเดียวกัน คือ โลหะในหมู่ IA , IIA, และ IIIA ใน คาบต่างๆ “จุดหลอมเหลวและจุดเดือดมีแนวโน้มสูงขึ้น เมื่อเลขอะตอม เพิ่มขึ้น” เนื่องจากมีพันธะโลหะที่แข็งแรงมากขึ้น ทั้งนี้เพราะอะตอมมี ขนาดเล็กลงและมีจานวนเวเลนต์อิเล็กตรอนเพิ่มขึ้น 58. 59. 60. จุดเดือดและจุดหลอมเหลวของอโลหะ
ก.อโลหะในหมู่เดียวกัน คือ หมู่ VIA , VIIA, และ VIIIA “จุด หลอมเหลวและจุดเดือดมีแนวโน้มเพิ่มขึ้น เมื่อเลขอะตอมเพิ่มขึ้น” เนื่องจากแรงยึดเหนี่ยวระหว่างโมเลกุลคือแรงวันเดอร์วาลส์เพิ่มขึ้น เพราะ มวลโมเลกุลและขนาดโมเลกุลเพิ่มขึ้น
ข. อโลหะในคาบเดียวกัน คือ อโลหะ หมู่ VA, VIA , VIIA, และ VIIIA “จุดหลอมเหลวและจุดเดือดมีแนวโน้มลดต่าลงเมื่อเลขอะตอม เพิ่มขึ้น” เนื่องจากแรงยึดเหนี่ยวระหว่างโมเลกุลคือ แรงวันเดอร์วาลส์มีค่า ลดลง เพราะขนาดของโมเลกุลเล็กลง โดยเฉพาะก๊าซเฉื่อยเป็นก๊าซประเภท โมเลกุลเดี่ยว และมีขนาดเล็ก มีจุดหลอมเหลวและจุดเดือดต่ามาก 61. 62. 63. 64. 65. 66. 67. Oxidation Number
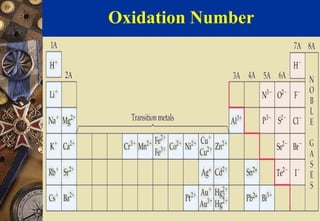
เลขออกซิเดชัน ( Oxidation Number ) เป็นตัวเลขเพื่อแสดงค่า ประจุไฟฟ้าหรือประจุไฟฟ้าสมมติของไอออนหรืออะตอมของธาตุ ซึ่งส่วน ใหญ่เป็นเลขจานวนเต็มรวมทั้งศูนย์และอาจมีเครื่องหมายเป็นบวกหรือลบก็ ได้
การกาหนดค่าเลขออกซิเดชัน มีกฎดังนี้ คือ
1. อะตอมของธาตุต่างๆ ในสภาวะอิสระ ไม่ว่าจะอยู่ในรูปที่เป็น อะตอมเดียว หรือโมเลกุล จะมีเลขออกซิเดชันเท่ากับศูนย์ เช่น Na Be He O2S8
2. ไอออนที่มีอะตอมเดี่ยวเลขออกซิเดชันจะมีค่าเท่ากับประจุของ ไอออนนั้น 68. Oxidation Number
เช่น
Na+มีเลขออกซิเดชัน เท่ากับ +1
Be2+มีเลขออกซิเดชัน เท่ากับ +2
O2-มีเลขออกซิเดชัน เท่ากับ -2
3. เลขออกซิเดชันของโลหะอัลคาไล(หมู่ IA) และโลหะอัลคาไลน์ เอิร์ท(หมู่ IIA) ในสารประกอบต่างๆ มีค่าเท่ากับ +1และ +2ตามลาดับ
4. เลขออกซิเดชันของออกซิเจนในสารประกอบส่วนมาก มีค่า เท่ากับ -2 ยกเว้น
-สารประกอบเปอร์ออกไซด์ เช่น H2O2และ Na2O2
ออกซิเจนมีเลขออกซิเดชัน -1 69. Oxidation Number
-สารประกอบซุปเปอร์ออกไซด์ เช่น KO2
ออกซิเจนมีเลขออกซิเดชัน -1/2
-สารประกอบ OF2
ออกซิเจนมีเลขออกซิเดชัน +2
5. เลขออกซิเดชันของไฮโดรเจนในสารประกอบส่วนมากมีค่าเท่ากับ +1ยกเว้นในสารประกอบพวกไฮไดรด์ไอออนิกซึ่งไฮโดรเจนมีค่าเลขออกซิ- เดชันเท่ากับ -1เช่น LiAlH4และ NaBH4
6. ผลรวมทางพีชคณิตของเลขออกซิเดชันของอะตอมทั้งหมดในสูตร เคมีใดๆ จะมีค่าเท่ากับประจุสาหรับกลุ่มของอะตอมที่เขียนแสดงในสูตรนั้นๆ เช่น ผลรวมของเลขออกซิเดชันของ KMnO4เท่ากับ 0 ผลรวมของเลข ออกซิเดชันของ NO3-เท่ากับ -1 70. Oxidation Number
ตัวอย่างที่ 1 จงหาเลขออกซิเดชันของ S ใน H2SO4
สมมติเลขออกซิเดชันของ S = x
เลขออกซิเดชันของ H = +1
2 อะตอมของ H มีเลขออกซิเดชันรวม = (+1 2) = +2
เลขออกซิเดชันของ O = -2
4 อะตอมของ O มีเลขออกซิเดชันรวม = (-2 4) = -8
ผลรวมของเลขออกซิเดชันธาตุทั้งหมดในสารประกอบ
เท่ากับ 0
ดังนั้น +2 + x + (-8) = 0
x = +6
เลขออกซิเดชันของ S ใน H2SO4= +6
ตัวอย่างที่ 2 จงหาเลขออกซิเดชันของ Co ใน [Co(CN)6]4-
สมมติเลขออกซิเดชันของ Co = x
เลขออกซิเดชันของ CN-= -1
ผลรวมเลขออกซิเดชันของ CN = (-1 6) = -6
ผลรวมเลขออกซิเดชันธาตุทั้งหมดในไอออนเท่ากับประจุของ ไอออนเท่ากับ -4
ดังนั้น x + (-6) = -4
x = +2
เลขออกซิเดชันของ Co ใน [Co(CN)6]4-= +2 71. 72. 73.




























































![Oxidation Number
ตัวอย่างที่ 1 จงหาเลขออกซิเดชันของ S ใน H2SO4
สมมติเลขออกซิเดชันของ S = x
เลขออกซิเดชันของ H = +1
2 อะตอมของ H มีเลขออกซิเดชันรวม = (+1 2) = +2
เลขออกซิเดชันของ O = -2
4 อะตอมของ O มีเลขออกซิเดชันรวม = (-2 4) = -8
ผลรวมของเลขออกซิเดชันธาตุทั้งหมดในสารประกอบ
เท่ากับ 0
ดังนั้น +2 + x + (-8) = 0
x = +6
เลขออกซิเดชันของ S ใน H2SO4= +6
ตัวอย่างที่ 2 จงหาเลขออกซิเดชันของ Co ใน [Co(CN)6]4-
สมมติเลขออกซิเดชันของ Co = x
เลขออกซิเดชันของ CN-= -1
ผลรวมเลขออกซิเดชันของ CN = (-1 6) = -6
ผลรวมเลขออกซิเดชันธาตุทั้งหมดในไอออนเท่ากับประจุของ ไอออนเท่ากับ -4
ดังนั้น x + (-6) = -4
x = +2
เลขออกซิเดชันของ Co ใน [Co(CN)6]4-= +2](https://image.slidesharecdn.com/random-140901005526-phpapp02/85/slide-70-320.jpg)