Recommended
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
สมบัติตามหมู่และตามคาบของสาร
PDF
บทที่ 3 ปริมาณสารสัมพันธ์
PDF
ชุดกิจกรรมการเรียนรู้ชุดที่2พันธะไอออนิกdocx
PDF
เรื่องที่ 19 ฟิสิกส์อะตอม
PDF
บทที่ 10 ธาตุและสารประกอบในอุตสาหกรรม
PDF
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย
PDF
เฉลยแบบฝึกหัด17.5โครงสร้างdna
PDF
PDF
PDF
ใบความรู้ที่ 1 สภาพขั้วของโมเลกุลโคเวเลนต์
PDF
ใบงานที่ 2 การจัดเรียงอิเล็กตรอน
PDF
PDF
PDF
ธาตุและสารประกอบ (elements and compound)
PDF
PPTX
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PDF
ชุดกิจกรรมการเรียนรู้วิทยาศาสตร์ เรื่อง สารและการจำแนกสาร ชุดที่ 1 สสารและสาร
PDF
PDF
สื่อการสอน Chemical equilibrium
PDF
PDF
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 1
PDF
PDF
PDF
PDF
06 สมบัติของสารประกอบไอออนิก
PDF
พันธะเคมี - Chemical bonds
More Related Content
PDF
บทที่ 3 สมบัติของธาตุและสารประกอบ
PDF
สมบัติตามหมู่และตามคาบของสาร
PDF
บทที่ 3 ปริมาณสารสัมพันธ์
PDF
ชุดกิจกรรมการเรียนรู้ชุดที่2พันธะไอออนิกdocx
PDF
เรื่องที่ 19 ฟิสิกส์อะตอม
PDF
บทที่ 10 ธาตุและสารประกอบในอุตสาหกรรม
PDF
DOC
โจทย์อัตราการเกิดปฎิกิริยา พร้อมเฉลย
What's hot
PDF
เฉลยแบบฝึกหัด17.5โครงสร้างdna
PDF
PDF
PDF
ใบความรู้ที่ 1 สภาพขั้วของโมเลกุลโคเวเลนต์
PDF
ใบงานที่ 2 การจัดเรียงอิเล็กตรอน
PDF
PDF
PDF
ธาตุและสารประกอบ (elements and compound)
PDF
PPTX
PDF
มวลอะตอม มวลโมเลกุล มวลไอออน
PDF
ชุดกิจกรรมการเรียนรู้วิทยาศาสตร์ เรื่อง สารและการจำแนกสาร ชุดที่ 1 สสารและสาร
PDF
PDF
สื่อการสอน Chemical equilibrium
PDF
PDF
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 1
PDF
PDF
PDF
Viewers also liked
PDF
06 สมบัติของสารประกอบไอออนิก
PDF
พันธะเคมี - Chemical bonds
PDF
ใบความรู้ 2 สมบัติของสารประกอบไอออนิก
PPT
พันธะเคมี Part ionic bonds
PDF
PDF
PDF
PDF
พันธะโคเวเลนต์ Covalent Bond
PDF
PDF
แบบทดสอบ การงานอาชีพฯ ม.6
PDF
PDF
ชุดกิจกรรมการเรียนรู้ชุดที่1พันธะโคเวเลนต์docx
PPT
PDF
สมบัติพีริออดิก - Periodic
PDF
PDF
DOCX
DOC
6. ข้อสอบ o net - การงานฯ (มัธยมปลาย)
PDF
ปริมาณสารสัมพันธ์ - Stoichiometry
PDF
Similar to Ch 02 ionic bond
PDF
PDF
พันธะเคมี Part ionic bonds
PDF
PDF
PDF
พันธะเคมี-(Chemical Bonding)มทร.ล้านนา.pdf
PDF
PDF
PPT
PPT
PPT
PPT
PDF
วิชาเคมี ม.ปลาย เรื่องตารางธาตุ
PPT
PDF
PPT
สมบัติของธาตุและสารประกอบ2
PDF
PDF
PDF
PDF
Science (chemistry) o-anet_1
PDF
วิชาเคมี ม.ปลาย เรื่องธาตุและสารประกอบในอุตสาหกรรม
More from kruannchem
PDF
PDF
PDF
04 แบบจำลองอะตอมของโบร์และกลุ่มหมอก
PDF
03 คลื่นและสมบัติของคลื่นสเปกตรัมของธาตุ
PDF
02 สัญลักษณ์นิวเคลียร์ของธาตุ
PDF
Ch 02 ionic bond 1. 2. 3. นิยามพันธะเคมี
แรงยึดเหนี่ยวระหว่างอนุภาคของสารเพื่อให้อะตอม
รวมกันเป็นโมเลกุลหรือให้โมเลกุลรวมกันเป็นกลุ่มก้อน
ไอออน-ไอออน อะตอม-อะตอม โมเลกุล-โมเลกุล
4. 5. 6. พันธะไอออนิก (Ionic bond)
คือแรงที่เกิดจากประจุไฟฟ้าบวก (+) และลบ (-) ดึงดูดเข้าหากันและ
เรียกสารที่เกิดขึ้นว่าสารไอออนิก (Ionic Compound) สารไอออนิกเกิด
จากโลหะให้ Valence - electron แก่อโลหะทั้งนีเ้ พราะโลหะมีค่า
IE1 ต่่า แต่อโลหะมีคา EN สูง เช่น
่
atom ที่สูญเสี ย e- จะกลายเป็ น ไอออนบวก (Cation)
atom ที่รับ e- จะกลายเป็ น ไอออนลบ (Anion)
7. เช่ น NaCl
Na11
1s 2s 2p 3s 3p 3d
Cl9
1s 2s 2p 3s 3p 3d
อาจกล่าวได้ว่ากลไกการเกิดพันธะไอออนิกเกิดผ่านปฏิกริยา 2 ขั้นตอนดังนี้
ิ
1. ขั้นการแตกไอออนของ Na และการรับอิเล็กตรอนของ Cl
Na . Na+ + e-
.. .
..Cl + e- ..
..Cl ..-
.. ..
8. 2. ไอออนที่เกิดขึ้นมารวมกัน
+
Na + ..
..
..Cl ..- ..
..Cl ..-
Na+ ..
กรณีอื่นทีสามารถเกิดพันธะไอออนิกได้
่
เช่น การเผาแคลเซียมในบรรยากาศออกซิเจน
2Ca(s) + O2(g) 2CaO
การเผาลิเทียมในอากาศ
4Li(s) + O2(g) 2Li2O
9. 12. ลักษณะส่าคัญของสารประกอบไอออนิก
1. พันธะไอออนิกเป็นพันธะทีเ่ กิดจาก ไอออนของโลหะ + ไอออนของอโลหะ เช่น NaCl, MgO, KI
2. พันธะไอออนิก อาจเป็นพันธะเคมีทเี่ กิดจากธาตุทมีคาพลังงานไอออไนเซชันต่ากับธาตุทมีคาพลังงาน
ี่ ่ ่ ี่ ่
ไอออไนเซชันสูง
3. พันธะไอออนิก อาจเป็นพันธะทีเ่ กิดจากไอออนบวกทีเ่ ป็นกลุมอะตอมของอโลหะ เช่น
่
4. สารประกอบไอออนิกไม่มีสตรโมเลกุล มีแต่สูตรเอมพิรคล ( สูตรอย่างง่าย )
ู ิ ั
5.สารประกอบไอออนิกมีจุดเดือดและจุดหลอมเหลวสูง
6. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง ประกอบไอออนบวกและไอออนลบ ไอออนเหล่านีไม่ ้
เคลื่อนที่ ดังนั้นจึงไม่นาไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้า จะแตกตัวเป็นไอออนและเคลือนทีได้
่ ่ ่ ่
เกิดเป็นสารอิเล็กโทรไลต์จึงน่าไฟฟ้าได้
15. ตัวอย่ าง จงเขียนสู ตรของสารประกอบไอออนิกต่ อไปนี้
ก. Na+ กับ O2- ข. Ca2+ กับ Cl- ค. NH4+ กับ SO42-
17. จงเขียนสู ตรอย่ างง่ ายของสารประกอบไอออนิกต่ อไปนี้
1. Na กับ Cl NaCl 2. Mg กับ P Mg3P2
3. Mg กับ O MgO 4. Mg กับ N Mg3N2
5. Na+ กับ CO32- Na2CO3 6. Ca2+ กับ PO43- Ca3(PO4)2
7. Na กับ S Na2S 8. Mg กับ Cl MgCl2
9. Al กับ O Al2O3 10. PO43- กับ Na+ Na PO
3 4
18. การอ่ านชื่อสารประกอบไอออนิก
อ่ านชื่อไอออนบวกก่ อน หรื อกลุ่มโลหะ
อ่ านชื่อไอออนลบ ตามหลัง
ไม่ ต้องอ่ า่อไอออนบวกเป็ นโลหะทรานซิ ช(ที่ อยู่
* เมื นเลขที่แสดงจานวนอะตอม น ั
ให้บอกเลขโรมันงขวา) บ ( ) ด้วย
ด้ านล่ า ในวงเล็
ชื่อโลหะให้ ลงท้ ายด้ วยไอด์ (-ide) เช่ น oxide,
chloride, sulphide ถ้ าเป็ นพวกอนุมูลกรด ให้ อ่าน
ตามชื่อ เช่ น ซัลเฟต ฟอตเฟต คาร์ บอเนต
19. เช่ น ไฮโดรเจน เป็ น ไฮไดรด์ (hydride)
คลอรีน เป็ น คลอไรด์ (chloride)
โบรมีน เป็ น โบรไมด์ (bromide)
22. การเรียกชื่อทางเคมี
BaCl2 barium chloride
K2O potassium oxide
Mg(OH)2 magnesium hydroxide
KNO3 potassium nitrate
FeCl2 iron (II) chloride
Cr2S3 chromium (III) sulfide
Cu(NO3)2 copper (II) nitrate
NH4ClO3 ammonium chlorate
23. สมบัติบางประการของสารประกอบไอออนิก
สารประกอบไอออนิกทุกชนิดมีสถานะเป็นของแข็ง
หรือผลึก ที่อุณหภูมิหอง และเปราะ
้
โครงสร้างของสารประกอบไอออนิกมีลักษณะเป็นผลึก
ผลึกสารประกอบไอออนิกมีรปทรง
ู
เป็นรูปลูกบาศก์ ประกอบ ด้วยไอออนบวก
และไอออนลบเรียงสลับกันเป็นสามมิตแบบิ
ต่างๆ ไม่สามารถแยกเป็น โมเลกุลเดี่ยวๆ ได้
24. สมบัติบางประการของสารประกอบไอออนิก
2. สารประกอบไอออนิกในภาวะปกติเป็นของแข็ง
ประกอบด้วยไอออนบวกและไอออนลบ ไอออนเหล่านี้ไม่เคลือนที่ จึง
่
ไม่น่าไฟฟ้า แต่เมื่อหลอมเหลวหรือละลายน้่า จะแตกตัวเป็นไอออน
และเคลื่อนทีได้ จึงน่าไฟฟ้าได้
่
25. สมบัติบางประการของสารประกอบไอออนิก
3. สารประกอบไอออนิกมีจุดดือดและจุดหลอมเหลวสูงมาก
4. สารประกอบไอออนิกบางชนิดละลายน้าได้ดีและบางชนิด
่
ไม่ละลายน้า
่
การที่สารประกอบไอออนิกละลายน้าได้เนื่องจากแรงดึงดูด
่
ระหว่างโมเลกุลของน้่ากับไอออนมีคามากกว่าแรงยึดเหนี่ยวระหว่าง
่
ไอออนบวกกับไอออนลบ
26. การพิจารณาความเป็นไอออนิกหรือโควาเลนต์
ถ้ามีค่า EN ต่างกันมากๆ จะมีสมบัติความเป็น ไอออนิกมาก
แต่ถ้ามีค่า EN ต่างกันน้อย จะมีสมบัติความเป็นโควาเลนต์มาก
* โดยทั่วไปถ้าธาตุคู่ร่วมพันธะมีค่า EN ต่างกันมากกว่า 1.8
ขึ้นไป จัดเป็น “พันธะไอออนิก”
27. 29. พลังงานแลตทิซของสารประกอบไอออนิก (Lattice Energy of Ionic Compound)
ปกติค่าพลังงาน IE, EA จะแสดงถึงความเป็ นไปได้ ที่จะเกิดสารประกอบ
ไอออนิก โดยความเสถียรของสารประกอบไอออนิกวัดได้ จาก พลังงานแลตทิซ
(LatticeงEnergy)
** พลั งานที่คายออกมา เมื่อไอออนในภาวะแก๊ส ทาปฏิกิริยากัน
เกิดเป็ นสารประกอบไอออนิกสารประกอบไอออนิกา ่เป็“พลังงานโครงผลึก/
นิยาม “ พลังงานที่ใช้ ทาให้ ที่เป็ นของแข็ง เรี ยกว่ ที นของแข็ง 1 mole
พลังงานแลตทิซ”(U)
กลายเป็ นไอออนของก๊าซ ”
Lattice energy (kJ/mol) m.p. (oC)
LiF 1,017 845
LiCl 828 610
LiBr 787 550
LiI 732 450
30. การค่านวณค่าพลังงานแลตทิซโดยใช้ Born – Habor Cycle
พลังงานแลตทิซวัดโดยตรงไม่ได้ ต้องค่านวณทางอ้อมโดยใช้ Born–Habor
cycle ซึ่งแบ่งออกเป็นขันตอนย่อย ๆ แสดงความสัมพันธ์ระหว่าง Lattice energy
้
กับ IE, EA และ คุณสมบัติของไอออนหรือโมเลกุลนันๆ
้
ตัวอย่าง จงค่านวณค่าพลังงานแลตทิซของสมการ
LiF (s) Li + (g) + F – (g) , H = ?
31. พลังงานกับการเกิดสารประกอบไอออนิก
E การระเหิด
1 Na(s) Na(g) ∆ H1 = +107 kJ/mol
E การสลายพันธะ
2 ½ Cl2(g) Cl(g) ∆H2 = +122 kJ/mol
IE
3 Na (g) Na+ (g) + e- ∆H3 = +496 kJ/mol
EA
4 Cl (g) + e- Cl- (g) ∆H4 = - 349 kJ/mol
5 Na +(g) + Cl-(g) E แลตทิซ NaCl(s) ∆H5 = - 787 kJ/mol
32. Na+ (g) + e - + Cl(g)
4
∆H3 = +496 kJ 3 ∆H4 = -349 kJ
Na(g) + Cl(g) Na+(g) + Cl-(g)
∆H2 = +122 kJ ∆Hf = (+107)+(+122)+(+496)+(-349)+(-787) = - 411 kJ/mol
2
Na(g) + 1/2Cl2(g)
วัฏจักรบอร์น –∆Hฮาเบอร์
= -787 kJ
5
∆H1 = +107 kJ 1 5
เริ่มต้ น Na(s) + 1/2Cl2(g) ∆Hf คือ พลังงานรวมของปฏิกิริยา
∆Hf = -411 kJ/mol
สุ ดท้ าย NaCl (s)
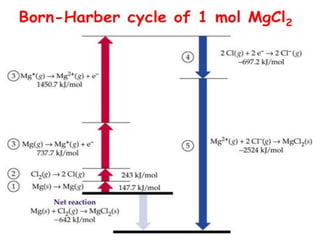
36. ?
จะเขียนได้ วา Hof = Ho1 + Ho2 + Ho3 + Ho4 + Ho5
่
-594.1 kJ = 155.2 kJ + 75.3 kJ + 520 kJ - 328 kJ + Ho5
ดังนัน H05 = - 1,017 kJ
้
พลังงานแลตทิซของ LiF เท่ากับ -1,017 kJ
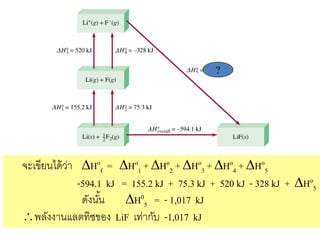
37. เราสามารถอธิบายการเกิด LiF (s) ออกเป็ นขั้นตอนย่ อย 5 ขั้นตอนคือ
1. Li (s) Li (g) Ho1 = 155.2 kJ (Sublimation)
2. ½ F2 (g) F (g) Ho2 = 75.3 kJ (Dissociation)
3. Li (g) Li+ (g) + e- Ho3 = 520 kJ (IE)
4. F (g) + e- F – (g) Ho4 = - 328 kJ (EA)
5. Li+ (g) + F – (g) LiF (s) Ho5 = ?
Li (s) + ½ F2 (g) LiF (s) Hof = - 594.1 kJ
จะเขียนได้วา Hof = Ho1 + Ho2 + Ho3 + Ho4 + Ho5
่
-594.1 kJ = 155.2 kJ + 75.3 kJ + 520 kJ - 328 kJ + Ho5
ดังนั้น H05 = - 1,017 kJ
พลังงานแลตทิซของ LiF เท่ากับ -1,017 kJ
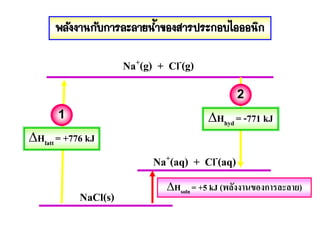
38. 39. ขั้นตอนการละลายน้่า
1. ท่าให้อนุภาคของของแข็งแยกออกจากกัน เป็นการท่าลายแรงยึดเหนียวระหว่างอนุภาค ขั้นตอนนีต้องใช้
่ ้
พลังงานซึงมีคาเท่ากับพลังงานโครงร่างผลึก (พลังงานโครงร่างผลึก Lattice energy คือ พลังงานที่
่ ่
ใช้แยกอนุภาคของของแข็งออกจากกันในภาวะแก๊ส) จะได้
NaCl(s) + พลังงานโครงร่างผลึก Na+(g) + Cl-(g) : ดูดพลังงาน H1
ขั้นตอนนีเ้ ป็นการดูดพลังงานเพือสลายพันธะเดิมของ NaCl
่
2. อนุภาคทีถูกแยกออกมาจากขันตอนแรกจะไปจับกับอนุภาคน้า อนุภาคของน้าจะคายพลังงาน
่ ้ ่ ่
ออกมาจ่านวนหนึง เรียกว่า พลังงานไฮเดรชัน (Hydration energy)
่
Na+(g) + Cl-(g) Na+(aq) + Cl-(aq) : คายพลังงาน H2
ขั้นตอนนีเ้ ป็นการคายพลังงานเพือสร้างพันธะกับน้า โดย aq มาจาก aqueous หมายถึง
่ ่
สารละลายทีมีนาเป็นตัวท่าละลาย
่ ้่
40. ขั้นตอนการละลายน้่า
ถ้ าเรารวมขันตอนทัง 2 เข้ าด้ วยกันจะได้
้ ้
NaCl(s) + พลังงานโครงร่ างผลึก Na+(aq) + Cl-(aq) : H3
โดย : H3 = H1 - H2
ถ้ า H3 เป็ นค่ าบวกแสดงว่ าดูดความร้ อน
ถ้ า H3 เป็ นค่ าลบแสดงว่ าคายความร้ อน
ถ้ า H3 แสดงว่ าไม่ ดูดไม่ คายความร้ อน
41. พลังงานไฮเดรชัน (hydration energy) เป็นพลังงานที่ปล่อย (คาย) ออกมา เมื่อ
ไอออนบวกและไอออนลบในสถานะแก๊สที่หลุดออกมาจากโครงผลึก
ของสารประกอบไอออนิกถูกโมเลกุลน้่าล้อมรอบ เกิดเป็นแรงยึดเหนี่ยวระหว่าง
โมเลกุลของน้่ากับไอออนบวกและลบ ดังสมการ
Na+(g) + Cl-(g) H2O Na+ (aq) + Cl-(aq) + 764 kJ/mol
## สารใดมีพลังงานไฮเดรชันมากจะยิงละลายน้ าได้ดี
่
พลังงานแลตทิช (Lattice energy) เป็ นพลังงานที่ใช้ในการสลายโครงผลึกของ
สารประกอบไอออนิกเป็ นไอออนบวกและไอออนลบในสถานะแก๊ส(หรื อ เป็ น
พลังงานที่คายออกมาเมื่อไอออนบวกและไอออนลบในสถานะแก๊สรวมตัวกันเกิด
เป็ นโครงผลึกของสารประกอบไอออนิก
คายพลังงาน
Na+(g) + Cl-(g) NaCl(s) + 768.3 kJ/mol
ดูดพลังงาน
NaCl(s) Na+(g) + Cl-(g) ; = +768.3 kJ/mol
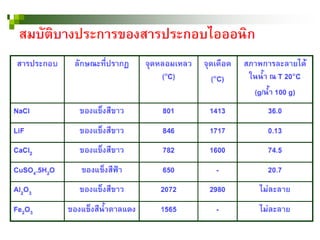
42. 43. สรุปการละลายน้่าของสารประกอบไอออนิก
∆Hlattice > ∆Hhydration แสดงว่ ามีการดูดพลังงาน
∆Hhydration > ∆Hlatticeแสดงว่ ามีการคายพลังงาน
∆Hlattice >>> ∆Hhydration แสดงว่าสารไอออนิกนั้นไม่ ค่อยละลาย
สารที่ละลายน้ าได้ < 0.1 g/H2O 100 cm3 ที่ 25 0C แสดงว่าไม่ละลาย
สารที่ละลายน้ าได้ 0.1-1.0 g/H2O 100 cm3 ที่ 25 0C แสดงว่าละลายได้บางส่ วน
สารที่ละลายน้ าได้ > 1.0 g/H2O 100 cm3 ที่ 25 0C แสดงว่าละลายได้ดี
45. 47. อภิปรายผลการทดลอง
สารทั้ง 3 ชนิดละลายในน้าได้แตกต่างกัน ดังต่อไปนี้
่
NH4Cl ละลายในน้่าได้อย่างรวดเร็ว
การเปลียนแปลงประเภทดูดความร้อน
่
NaCl ละลายในน้าได้ดี มีการเปลี่ยนแปลงพลังงานน้อยมาก
่
เพราะอุณหภูมของสารละลายเกือบคงที่
ิ
CuSO4 ละลายในน้่าได้ช้า
การเปลียนแปลงประเภทคายความร้อน
่
48. อภิปรายผลการทดลอง (ต่อ)
อุณหภูมิเป็นป―จจัยส่าคัญอย่างหนึ่งที่มีผลต่อการละลายของสาร
สารที่ละลายในตัวท่าละลายได้มากขึ้น เมื่ออุณหภูมของสารละลายสูงขึน
ิ ้
จะมีขั้นตอนในการละลายเป็นแบบดูดพลังงาน เช่น NH4NO3
ส่วนสารละลายในตัวท่าละลายได้น้อยลง เมื่ออุณหภูมของสารละลาย
ิ
เพิ่มขึน จะมีขั้นตอนในการละลายเป็นแบบคายพลังงาน เช่น Ce2(SO4)3
้
50. ผลการทดลอง
การเปลี่ยนแปลงเมื่อเติมสารละลาย
สารละลาย Na2CO3 NH4Cl Pb(NO3)2
Ca(OH)2 เกิดตะกอนสีขาว ไม่ เกิดตะกอน เกิดตะกอนสีขาว
Na2SO4 ไม่ เกิดตะกอน ไม่ เกิดตะกอน เกิดตะกอนสีขาว
KI ไม่ เกิดตะกอน ไม่ เกิดตะกอน เกิดตะกอนสีเหลือง
1. เมื่อผสมสารละลาย 2 ชนิดเข้าด้วยกันแล้วไม่มตะกอนเกิดขึน แสดงว่า
ี ้
ไอออนในสารละลายไม่รวมตัวกัน จึงไม่มีปฏิกรยาเคมีเกิดขึ้น
ิิ
2. เมื่อผสมสารละลาย 2 ชนิด เข้าด้วยกันแล้ว มีตะกอนเกิดขึ้น แสดงว่า
ไอออนในสารละลายรวมตัวกันเกิดเป็นสารใหม่ที่ไม่ละลายในน้า หรือมี
่
ปฏิกิรยาเคมีเกิดขึ้น
ิ
52. เกลือชนิดที่ไม่ละลายน้าและละลายน้่าได้มดังนี้
่ ี
• เกลือของโลหะไอออนหมู่ 1A และ NH4+ ละลายน้่าได้หมด
• เกลือของไอออนลบของไนเตรด (NO3-) อะซีเตต (CH3COO-) คลอเรต
(ClO3-) และเปอร์คลอเรต(ClO4-) ละลายได้หมด
• เกลือคลอไรด์ โบรไมด์ และไอโอไดด์ ละลายน้่าได้ ยกเว้นเกลือคลอไรด์ โบรไมด์
และไอโอไดด์ของ Ag+, Pb2+ , Hg2+ , Hg22+ ไม่ละลายน้า ่
• เกลือซัลเฟต(SO42-) คาร์บอเนต(CO32-) ซัลไฟด์(S2-) ฟอสเฟต(PO43-)
และอาร์เซเนต(AsO43-) ของโลหะไอออนหมู่ 2A และ Ag+, Pb2+ , Hg2+
ไม่ละลายน้่า ยกเว้นเกลือดังกล่าวของหมู่ 1A , NH4+ และ MgSO4 ละลายน้่า
• เกลือไฮดรอกไซด์ (OH-) ไม่ละลายน้่า ยกเว้น OH- ของโลหะไอออนหมู่ 1A ,
NH4+ ละลายน้่าได้
53. 54. ตัวอย่าง น่าคอปเปอร์(II)โบรไมด์ จ่านวน 0.860 กรัม มาละลายในน้่า 100 cm3
พบว่าอุณหภูมของน้าเปลียนจาก 23.10 oC เป็น 23.41 oC จงค่านวณหาปริมาณ
ิ ่ ่
ความร้อนที่เกิดขึน และความสัมพันธ์ระหว่างค่าพลังงานแลตทิช และพลังงาน
้
ไฮเดรชันเป็นอย่างไร
จากอุณหภูมเิ พิมขึ้น 23.10 oC เป็น 23.41 oC แสดงว่าการละลายของ CuBr2
่
เป็นการคายความร้อน ดังนั้น พลังงานแลตทิชน้อยกว่าพลังงานไฮเดรชัน
Q = mc t
= (100)(4.2)(23.41-23.10)
= 130.2 J
ข้ อสั งเกต - ถ้ าเกลือทีละลายนาเป็ นกระบวนการดูดความร้ อน เมือเพิมอุณหภูมให้ กบ
่ ้ ่ ่ ิ ั
สารละลายการละลายจะเพิมขึน ่ ้
- ถ้ าเกลือทีละลายนาเป็ นกระบวนการคายความร้ อน เมือเพิมอุณหภูมให้ กบ
่ ้ ่ ่ ิ ั
สารละลายการละลายจะลดลง
55. ปฏิกิรยาของสารประกอบไอออนิก
ิ
Cl- Ag+
Na+ NO3-
สารละลาย NaCl สารละลาย AgNO3
NaCl Na+(aq) + Cl-(aq) AgNO3 Ag+(aq) + NO3-(aq)
AgCl (s)
Na+(aq) + Cl-(aq) + Ag+(aq) + NO3-(aq) Na+(aq) + Cl-(aq) + AgCl(s)
สมการไอออนิก
56. 57. การเขียนสมการไอออนิก
จากที่ทราบแล้วว่า เมื่อสารประกอบไอออนิกละลายในน้่า ไอออนบวก และ
ไอออนลบจะแยกออกจากกันและถูกล้อมรอบด้วยโมเลกุลของน้่าหลายโมเลกุล
เมื่อผสมสารละลายแคลเซียมไฮดรอกไซด์ (Ca(OH)2) กับสารละลาย
โซเดียมคาร์บอเนต (Na2CO3) แล้วพบว่ามีตะกอนสีขาวเกิดขึน ตะกอนนี้ไม่ควร
้
เป็นโซเดียมไฮดรอกไซด์ (NaOH) เพราะว่า NaOH ละลายได้ในน้าและแตกตัว
่
เป็นไอออนอยู่ในของเหลว ดังนั้นจึงเป็นตะกอนของแคลเซียมคาร์บอเนต
(CaCO3) สามารถเขียนสมการได้ดังนี้
Ca2+(aq) + 2OH- (aq) + 2Na+(aq) + CO32-(aq) ---------> CaCO3(s) + 2OH-(aq) + 2Na+(aq)
58. 59. NaCl (s) Na+ (aq) + Cl- (aq)
AgNO3 (s) Ag+ (aq) + NO3- (aq)
Na+(aq) + Cl-(aq) + Ag+(aq) + NO3-(aq) Na+(aq) + Cl-(aq) + AgCl(s)
สมการไอออนิก
Cl-(aq) + Ag+(aq) AgCl(s)
สมการไอออนิกสุ ทธิ
60. 61. 62. 63. Cl-
Cs+
2) โครงสร้ างผลึกของ CsCl
Cs+ มี Cl- ห้อมล้อมและสัมผัส 8 ไอออน Cl-
มี Cs+ ห้อมล้อมและสัมผัส 8 ไอออน
3) โครงสร้ างผลึกของ CaF2
F- Ca 2+
Ca2+ มี F- ห้ อมล้ อมและสัมผัส 8 ไอออน
แต่ F- มี Ca2+ ห้ อมล้ อมและสัมผัสเพียง 4
ไอออนเท่านัน ้
การเขียนสูตรสารประกอบไอออนิกจะแสดง
อัตราส่วนอย่างต่าของไอออนที่มารวมตัว
กันนเท่านัน Ca 2+ : F- = 4:8 = 1:2
้
สูตรจึงเป็ น CaF2
64. พลังงานพันธะ (Bond Energy)
พลังงานพันธะ หรือ พลังงานสลายพันธะ (Bond dissociation energy, D)
คือ พลังงานที่ต้องใช้ในการสลายพันธะเคมีแต่ละพันธะในโมเลกุล
(มีค่าเป็นบวก) เช่น
H2(g) 2H(g) D(H—H) = 436 kJ/mol
• พันธะเคมีชนิดเดียวกันในโมเลกุลที่ต่างกันอาจมีค่าพลังงานสลายพันธะต่างกัน
เช่น C-H
– CH4(g) CH3(g) + H(g) D(H-C)CH4 = 436 kJ/mol
– CH3(g) CH2(g) + H(g) D(H-C)CH3 = 368 kJ/mol
– CH2(g) CH(g) + H(g) D(H-C)CH2 = 519 kJ/mol
– CH(g) C(g) + H(g) D(H-C)CH = 335 kJ/mol
65. 66. ความร้อนของปฏิกิรยา (Heat of Reaction)
ิ
การเกิดปฏิกรยาเคมี คือกระบวนการที่มีการท่าลายพันธะเดิม (สารตั้งต้น)
ิิ
และสร้างพันธะใหม่ (สารผลิตภัณฑ์)
ความร้อนของปฏิกรยา (
ิิ Hrxn) คือพลังงานเอนทาลปีของระบบที่
เปลี่ยนแปลงไปในรูปความร้อนเมื่อเกิดปฏิกิริยา
สามารถหาได้จาก
H rxn D D
reactants products
พลังงานพันธะรวม พลังงานพันธะรวม
ของสารตั้งต้ น ของผลิตภัณฑ์
– DHrxn เป็นลบ ปฏิกิริยาคายพลังงาน
– DHrxn เป็นบวก ต้องใช้พลังงานเพื่อให้เกิดปฏิกิริยา (ดูดพลังงาน)
67. การค่านวณหาค่าความร้อนของปฏิกรยา
ิิ
ตัวอย่ าง จงหาพลังงานที่เปลี่ยนแปลงของปฏิกิริยาต่อไปนี ้
CH4(g) + Cl2(g) CH3Cl (g) + HCl(g)
– D (พลังงานพันธะสารตังต้ น) = 4D(C-H) + D(Cl-Cl)
้
reactants
– D (พลังงานพันธะผลิตภัณฑ์ ) = D(C-Cl) + 3D(C-H) + D(Cl-H)
products
• Hrxn = 4D(C-H) + D(Cl-Cl) – [D(C-Cl) + 3D(C-H) + D(Cl-H)]
= (4414 + 243) – (339 + 3414 + 431) kJ/mol = –113 kJ/mol
ปฏิกิริยานี ้จะคายความร้ อนออกมา 113 kJ/mol
68. ความยาวพันธะ (Bond Length)
ความยาวพันธะ คือระยะห่างระหว่างอะตอมคู่ที่สร้างพันธะ
โดยเป็นต่าแหน่งที่อะตอมทั้งสองดึงดูดกันได้ดีที่สุด มี
พลังงานต่่าสุดหรือมีเสถียรภาพที่สุด
• ความยาวของพันธะโควาเลนต์สัมพันธ์กับพลังงาน
พันธะ
– ความยาวพันธะเดี่ยว พันธะคู่ พันธะสาม
– พลังงานพันธะเดี่ยว พันธะคู่ พันธะสาม
Bond Bond
Length Energy
69. 70. มุมพันธะ
มุมพันธะ คือมุมที่เกิดขึ้น เมื่อลาก 106.0
เส้นผ่านพันธะ 2 พันธะมาตัดที่
นิวเคลียสของอะตอมกลาง 104.0
• โมเลกุลที่มีสูตรเคมีคล้ายกัน มุมพันธะอาจไม่เท่ากัน
– H2O = 104.5 H2S = 92
• การท่านายโครงสร้างของโมเลกุลเช่น มุมพันธะ จ่าเป็นต้องอาศัยข้อมูล
เกี่ยวกับอิเล็กตรอนในโมเลกุล
71. สภาพขัวของพันธะ (Bond Polarity)
้
สภาพขัวของพันธะ คือ การอธิบายการกระจายตัวของอิเล็กตรอนที่ใช้ในการ
้
สร้างพันธะระหว่างอะตอม
• สภาพขั้วของพันธะโควาเลนต์ขึ้นอยู่กับ ค่า EN ของอะตอมทั้งสอง ถ้าค่า
EN ของอะตอมทั้งสองต่างกัน การกระจายตัวของอิเล็กตรอนในบริเวณ
ระหว่างอะตอมทั้งสองจะไม่สม่่าเสมอ ซึ่งจะเรียกว่า พันธะโควาเลนต์แบบมีขว
ั้
X+Y- เมื่อ EN ของ Y X
H + F H F
+ -
72. สภาพขัวของโมเลกุล (Polarity of Molecule)
้
สภาพขัวของโมเลกุลคือสภาพขั้วสุทธิ (net dipole )ของพันธะทุกพันธะใน
้
โมเลกุล
• สภาพขั้วของโมเลกุลหาได้โดยการรวมสภาพขั้วของพันธะทุกพันธะแบบเวคเตอร์
73. 74. โมเมนต์ขวคู่
ั้ (Dipole Moments)
ภายในโมเลกุลของสารประกอบ ถ้าอะตอมมีคา EN ต่างกัน มีการดึง
่
อิเล็กตรอนท่าให้เกิดขัวขึน
้ ้
ตัวอย่าง แสดงทิศทางการดึงของ e-
H F
แสดงขัว (polar bond)
้ 2.1 4.0
-
+
H F H F
76. dipole moment สุ ทธิ = 1. 87
โมเลกุล H2O ...
O (เป็ น polar molecule)
H H
ขั้วของโมเลกุล คานวณจากผลรวมแบบ vector ของขั้วของพันธะ
โมเลกุล CO2 O C O เป็ น non-polar molecule
=0
โมเลกุล C2H2Cl2 Cl Cl H Cl
C C C C
Cl H
H H
Cis (polar) Trans = 0
= 1. 89






























































![การค่านวณหาค่าความร้อนของปฏิกรยา
ิิ
ตัวอย่ าง จงหาพลังงานที่เปลี่ยนแปลงของปฏิกิริยาต่อไปนี ้
CH4(g) + Cl2(g) CH3Cl (g) + HCl(g)
– D (พลังงานพันธะสารตังต้ น) = 4D(C-H) + D(Cl-Cl)
้
reactants
– D (พลังงานพันธะผลิตภัณฑ์ ) = D(C-Cl) + 3D(C-H) + D(Cl-H)
products
• Hrxn = 4D(C-H) + D(Cl-Cl) – [D(C-Cl) + 3D(C-H) + D(Cl-H)]
= (4414 + 243) – (339 + 3414 + 431) kJ/mol = –113 kJ/mol
ปฏิกิริยานี ้จะคายความร้ อนออกมา 113 kJ/mol](https://image.slidesharecdn.com/ch02ionicbond-120926094838-phpapp02/85/Ch-02-ionic-bond-67-320.jpg)








