More Related Content
PPT
PPT
PDF
PPT
PDF
PDF
บทที่ 2 โครงสร้างของของแข็ง the structure of solid PDF
PDF
What's hot
PDF
PPT
PPT
PPT
PDF
PDF
PDF
พันธะโคเวเลนต์ Covalent Bond PDF
PDF
ใบความรู้ที่ 1 สภาพขั้วของโมเลกุลโคเวเลนต์ PPTX
PDF
PDF
PDF
PDF
PDF
พันธะเคมี - Chemical bonds PDF
PPTX
โครงสร้างอะตอมและตารางธาตุ (โครงงานคอมพิวเตอร์) PDF
2.สรุปเนื้อหาเคมี เรื่อง โครงสร้างอะตอม PDF
PDF
วิชาเคมี เรื่องโครงสร้างอะตอม Similar to พันธะเคมี
PDF
PDF
ธาตุและสารประกอบ (elements and compound) PDF
SLIDE-01403117-CH02-CHEMICALBOND-FULL.pdf PDF
PPTX
PPTX
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง น้ำ PDF
พันธะเคมี-(Chemical Bonding)มทร.ล้านนา.pdf PDF
PDF
PDF
PPT
พันธะเคมี Part ionic bonds PDF
PDF
PDF
พันธะเคมี Part ionic bonds PDF
PDF
วิชาเคมี ม.ปลาย เรื่องตารางธาตุ PPT
PDF
PDF
พันธะเคมี
- 1.
- 2.
- 3.
- 4.
พันธะเคมี พันธะเคมี หมายถึง แรงดึงดูดระหวาง “อะตอม” “โมเลกุล”หรือ “ไอออน” เปนการให , รับ , หรือใช V.ē รวมกัน ทําใหอะตอมเสถียรกวาอยูเดี่ยว ๆ แรงทางเคมี - 5.
- 6.
- 7.
- 8.
- 9.
- 10.
- 11.
- 12.
- 13.
- 14.
- 15.
การเขียนสูตรสารประกอบไอออนิก ผลบวกของไอออนิกเวเลนซมีคาเปนศูนย์ cation ให ē anion รับ ē V.ē ครบ 8 ( กฏชุด 8) “ octet rule” ประจุบนไอออน = ไอออนิกเวเลนซ หรือ อิเล็กโทรเวเลนซ์ คือ ประจุที่เกิดจาก การให / รับ อิเล็กตรอนจริงๆ สูตร NaCl, MgCl 2 , CaO - 16.
- 17.
- 18.
สมบัติของสารประกอบไอออนิก ไมเปนโมเลกุล แตเปนกลุม cation กับ anion มาอยูรวมกัน เชน Na + Cl - ( ผลึก ) เมื่อเปนของแข็งไมนําไฟฟา นําไฟฟาเมื่อเปนของเหลวหรือสารละลาย จุดหลอมเหลวและจุดเดือดสูงความดันไอต่ำ ไอออนมีแรงดึงดูดกันอยางแรง ตองใชพลังงานมากใน การคลายไอออนออกจากกัน - 19.
สมบัติของสารประกอบไอออนิก ละลายไดดีใน solvent ที่มีคาคงตัวไดอิเล็กทริก (dielectric constant) สูง ไดแกสารมีขั้ว เชน H2O ( ความสามารถในการทําใหแรงดึงดูดของไอออน +, - ลดลง ) สวนมากแข็งแตเปราะ ปฏิกิริยามักเกิดเร็ว ( เกิดระหวาง ion) - 20.
- 21.
- 22.
- 23.
- 24.
พันธะโควาเลนซ์ พันธะโควาเลนซ์ คือ พันธะที่เกิดจากการที่อะตอมใชอิเล็กตรอนรวมกัน เกิดจากการรวมกันของธาตุที่เป็น อโลหะ + อโลหะ มี 2 แบบ คือ พันธะโคเวเลนตธรรมดา พันธะโคเวเลนตแบบโคออรดิเนต ทั้ง 2 แบบมีสมบัติเหมือนกัน แตการเกิดตางกัน - 25.
พันธะโควาเลนซ์แบบธรรมดา อะตอมใชคู ē รวมกัน แตละอะตอมมี V.ē ครบ 8 ( ยกเวน H ) อิเล็กตรอนที่ใชในการเกิด 1 พันธะ (2 อิเล็กตรอน ) - 26.
- 27.
2. พันธะคู่ ใช้ e ร่วมกัน 2 คู่ พันธะโควาเลนซ์แบบธรรมดา - 28.
- 29.
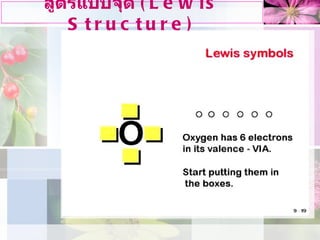
การเขียนสูตรลิวอิส ( โควาเลนซ์) 1. เขียนอะตอมทั้งหมดใหอะตอมที่เกิดพันธะกันอยูใกลกัน ( ถามี 3 อะตอม อะตอมที่ E.N. ต่ำาอยูกลาง ) ยกเวน H ใชเปนอะตอมกลางไมได้ 2. หาจํานวน V.ē ทั้งหมดซึ่ง = V.ē ของอะตอมทุกอะตอม รวมกัน Cation ลด ē ลงเทาประจุ Anion เพิ่ม ē เทาประจุ นํา ē ที่มีอยูไปเขียนรอบอะตอมตางๆ - 30.
การเขียนสูตรลิวอิส ( โควาเลนซ์) 3. ใช V .e เขียน รอบอะตอมที่อยูติดกัน คูละ 2 e 4. ใช e ที่เหลือเขียนรอบอะตอม ที่ ไมใชอะตอมกลาง ให ครบ 8 แลว จึงเขียนรอบ อะตอมกลาง 5. ถา ใชเวเลนซอิเล็กตรอนหมดแล วอะตอมกลางยังไมครบ 8 ē แสดงวาอาจมี พันธะคู หรือ พันธะสาม ดวย - 31.
- 32.
- 33.
- 34.
- 35.
การขยายกฎออกเทต (ExpandedOctet) หรือ ขอยกเวนของกฎออกเทต 1. สารประกอบของ Be, B Be, B มี ē รอบอะตอมกลางนอยกวา 8 เชน BeCl 2 , BF 3 - 36.
การขยายกฎออกเทต (ExpandedOctet) 2. ธาตุคาบ 3 ขึ้นไป ( เชน s , p ) เมื่อเปนอะตอมกลางอาจ มี ē > 8 ได ( อะตอมที่ไมใชอะตอมกลาง ē ตอง = 8 เสมอ ) หมู 5 เชน P (PCl 3 ē รอบ P = 8, PCl 5 ē รอบ P = 10) หมู 6 เชน S (SCl 3 + ē รอบ S = 8, SF6 ē รอบ S = 12) - 37.
อิเล็คตรอน ที่ใชในการ เกิดพันธะ 1 พันธะ (2ē) เรียกวา คูพันธะ (bonded pair) คูอิเล็คตรอน (2ē) ที่ไมไดใช ในการเกิดพันธะ เรียกวา คูโดดเดี่ยว (lone pair) แต อิเล็คตรอนเดี่ยว (single electron) คือ อิเล็คตรอนที่ไม่มีคู่ - 38.
- 39.
- 40.
- 41.
3. มีโมเลกุลที่เสถียร ที่มี V.ē เปนเลขคี่ ( มี ē เดี่ยว ) เชน NO (5 + 6 = 11 ē) การขยายกฎออกเทต (Expanded Octet) - 42.
- 43.
- 44.
- 45.
- 46.