More Related Content
PDF
PDF
สรุป วิชาโลก ดาราศาสตร์ และอวกาศ PDF
บทเรียนแบบโปรแกรมวิชาเคมี PDF
PPTX
Ep03 บวก ลบ คูณ หาร เลขนัยสำคัญ (เรียนฟิสิกส์กับครูอุ๋ย) PDF
PDF
แบบฝึกหัดทบทวนตามตัวชี้วัดหน่วยที่ 2 งานและพลังงาน PDF
What's hot
PDF
หน่วยที่ 4 สูตรเคมี (point) PDF
1 บทนำ แก๊สและสมบัติของแก๊ส PDF
แผนการจัดหน่วยการเรียนรู้ วิทยาศาสตร์ 2 ภาคเรียนที่ 2 ปีการศึกษา 2556 PDF
PDF
PDF
2ชุดฝึกทักษะกระบวนการคิดตามวิธีการทางวิทยาศาสตร์ PDF
PDF
แผนการจัดการเรียนรู้ เรื่อง แบบจำลองอะตอมของดอลตันและทอมสัน PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี PDF
PDF
PDF
บทที่ 1 พันธุกรรมกับหมู่เลือด PDF
13แบบทดสอบโครโมโซมและการถ่ายทอดลักษณะพันธุกรรม DOCX
PDF
PDF
แบบรายงานการแสดงทางวิทยาศาสตร์ PDF
PDF
พันธะโคเวเลนต์ Covalent Bond PDF
PDF
Viewers also liked
PDF
PDF
การบริหารจิตและเจริญปัญญา PDF
แผ่นพับสรุปวิจัยในชั้นเรียน PPSX
PDF
PDF
PDF
ตัวชี้วัดและสาระการเรียนรู้แกนกลาง PDF
03 บทที่ 3-วิธีดำเนินงานโครงงาน PDF
05 บทที่ 5-สรุปผล ข้อเสนอแนะ PDF
108 วิธี.. เรียนเก่ง โครต...โครต PDF
แผนผังวิเคราะห์การจัดการเรียนรู้ ว21101 วิทยาศาสตร์1 ครูกอบวิทย์ พิริยะวัฒน์ PDF
04 คู่มือแบบทดสอบก่อนเรียนหลังเรียน PDF
PDF
แบบเสนอโครงร่างโครงงานคอมพิวเตอร์ ครูสมร PDF
สไลด์ การบริหารจิตเจริญปัญญา+501+dltvsocp6+55t2soc p06 f02-1page PDF
แบบรายงานการพัฒนานวัตกรรมการพัฒนาคุณภาพผู้เรียนตามจุด PDF
PDF
02 บทที่ 2-เอกสารที่เกี่ยวข้อง PPT
PDF
Similar to สมดุลเคมี
PDF
PDF
PPT
DOCX
PPT
สมดุลเคมี โชติช่วง ดีดวงพันธ์ PPT
PPT
PPT
สมดุลเคมี ชินกร ดีดวงพันธ์ PPT
สมดุลเคมี วิสุพร ดีดวงพันธ์ PPT
PPT
PPT
สมดุลเคมี โชติช่วง ดีดวงพันธ์ PPT
สมดุลเคมี โชติช่วง ดีดวงพันธ์ PPT
สมดุลเคมี ชินกร ดีดวงพันธ์ PPT
สมดุลเคมี ธวัชชัย รุ่งโรจน์ PPT
สมดุลเคมี ยุวธิดา ดีดวงพันธ์ PPT
PPT
PPT
PPTX
More from Jariya Jaiyot
PDF
Lab 2 ปฏิกิริยาระหว่างกรดกับเบส PDF
บทที่ 3 เครื่องสำอางในชีวิตประจำวัน PDF
แบบทดสอบ เรื่อง การถ่ายทอดลักษณะทางพันธุกรรม PDF
ปัจจัยที่มีผลต่อสมดุลเคมี ปี 57 PDF
PDF
กระบวนการถ่ายทอดลักษณะทางพันธุกรรม PDF
แบบทดสอบ บทที่ 1 ปฏิสัมพันธ์ในระบบสุริยะ PDF
แบบทดสอบ เรืื่องพอลิเมอร์ PDF
แบบฝึกการหาอัตราเร็วความเร็ว PDF
PDF
PDF
การกัดกร่อนของโลหะและการป้องกัน PDF
PDF
ใบงานปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยา PDF
PDF
PDF
PDF
PDF
โครงการแผนที่ออนไลน์ป่าชุมชนอำเภอเวียงสา : กรณีศึกษา ป่าชุมชนบ้านบุญเรือง PPTX
สมดุลเคมี
- 2.
- 3.
- 4.
- 5.
- 6.
- 7.
- 8.
- 9.
- 10.
- 11.
- 12.
- 13.
- 14.
- 15.
- 16.
- 17.
- 18.
- 19.
- 21.
21
ปัจจัยที่มีผลต่อสมดุลเคมี (Factors thataffect chemical
equilibrium)
1. ความเข้มข้น 2. ความดัน 3. อุณหภูมิ
เมื่อระบบสมดุลถูกรบกวนด้วยปัจจัยเหล่านี้ ระบบจะปรับตัวเองให้
เข้าสู่สมดุลใหม่อีกครั้ง ตามหลักของเลอชาเตอลิเอ ( Le Chatelier’s
Principle) ที่กล่าวว่า
“ เมื่อระบบสมดุลถูกรบกวนจนสมดุลเสียไประบบจะปรับตัวใน
ทิศทางที่ท้าให้ปัจจัยรบกวนลดน้อยที่สุด เพื่อระบบจะเข้าสู่สมดุล
เดิม ”
- 22.
22
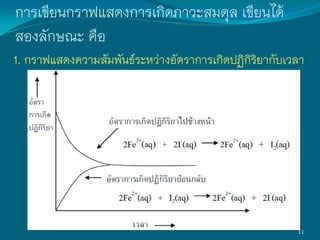
ปัจจัยที่มีผลต่อสมดุลเคมี
1. การเปลี่ยนความเข้มข้น
ระบบอยู่ในสมดุล Fe3+(aq)+ SCN-(aq) [FeSCN]2+(aq)
สีเหลือง ไม่มีสี สีแดง
ถ้าเติมสารละลาย Fe(NO3)3 มีผลท้าให้ปริมาณ Fe3+ ในระบบเพิ่มขึ้น
Fe(NO3)3(aq) Fe3+(aq) + NO3
-(aq)
ดังนั้น ระบบจึงปรับลดปริมาณ Fe3+ โดยเกิดปฏิกิริยาไปข้างหน้าในอัตราที่เร็ว
ขึ้นกว่าปฏิกิริยาย้อนกลับ ท้าให้เข้าสู่สมดุลใหม่อีกครั้ง
ณ สมดุลใหม่ Fe3+(aq) + SCN-(aq) [FeSCN]2+(aq)
ปริมาณสาร
- 23.
- 24.
- 25.
= NH3
= H2
=N2
2 ลิตร
1 ลิตร
สมดุลใหม่
N2(g) + 3H2(g) 2NH3(g)
1 โมล 3 โมล 2 โมล
- 26.
- 27.
27
3. การเปลี่ยนอุณหภูมิ
ถ้าเปลี่ยน ความเข้มข้นปริมาตร ความดัน ผลคือ เปลี่ยนสมดุล
การเปลี่ยนอุณหภูมิ ผลคือ สมดุลเปลี่ยน และค่า K เปลี่ยน
N2O4(g) + 58.0 kJ 2NO2(g) ดูดความร้อน
ลดอุณหภูมิ K ลดลง
เพิ่มอุณหภูมิ K เพิ่ม
2NO2(g) N2O4(g) + 58.0 kJ คายความร้อน
ลดอุณหภูมิ K เพิ่ม
เพิ่มอุณหภูมิ K ลด
- 28.
- 29.
ปฏิกิริยาดูดความร้อน (Ho บวก)ปฏิกิริยาคายความร้อน (Ho ลบ)
1. เพิ่มอุณหภูมิ ไปข้างหน้า
2. ลดอุณหภูมิ ย้อนกลับ
1. เพิ่มอุณหภูมิ ย้อนกลับ
2. ลดอุณหภูมิ ไปข้างหน้า
29
4. ผลจาก catalyst
- ช่วยลด activation energy ( Ea )
- ท้าให้อัตราเร็วของปฏิกิริยาเร็วขึ้น ทั้งไปข้างหน้าและย้อนกลับ
- ไม่มีผลต่อ Kและเปลี่ยนสมดุล
- 30.
- 31.




















![22
ปัจจัยที่มีผลต่อสมดุลเคมี
1. การเปลี่ยนความเข้มข้น
ระบบอยู่ในสมดุล Fe3+(aq) + SCN-(aq) [FeSCN]2+(aq)
สีเหลือง ไม่มีสี สีแดง
ถ้าเติมสารละลาย Fe(NO3)3 มีผลท้าให้ปริมาณ Fe3+ ในระบบเพิ่มขึ้น
Fe(NO3)3(aq) Fe3+(aq) + NO3
-(aq)
ดังนั้น ระบบจึงปรับลดปริมาณ Fe3+ โดยเกิดปฏิกิริยาไปข้างหน้าในอัตราที่เร็ว
ขึ้นกว่าปฏิกิริยาย้อนกลับ ท้าให้เข้าสู่สมดุลใหม่อีกครั้ง
ณ สมดุลใหม่ Fe3+(aq) + SCN-(aq) [FeSCN]2+(aq)
ปริมาณสาร ](https://image.slidesharecdn.com/random-130804105029-phpapp02/85/slide-22-320.jpg)








