More Related Content
PPT
PPT
สมดุลเคมี วิสุพร ดีดวงพันธ์ PPT
PPT
PDF
PPT
สมดุลเคมี ชินกร ดีดวงพันธ์ PPT
สมดุลเคมี ธวัชชัย รุ่งโรจน์ PPT
สมดุลเคมี ยุวธิดา ดีดวงพันธ์ What's hot
PPT
PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี PDF
PPT
อัตราการเกิดปฏิกิริยาเคมี (Rate of reaction PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี PPTX
PDF
5 ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี DOC
DOC
อัตราการเกิดปฎิกิริยาเคมี PPTX
PPTX
PPTX
Similar to สมดุลเคมี โชติช่วง ดีดวงพันธ์
PPT
สมดุลเคมี ชินกร ดีดวงพันธ์ PPT
PDF
PPT
PPT
PPT
PPT
PPTX
PPTX
PPTX
PPTX
PPTX
PPTX
PPTX
DOC
DOC
DOC
DOC
DOC
DOC
สมดุลเคมี โชติช่วง ดีดวงพันธ์
- 1.
- 2.
คำนำ ในเรื่องนี้ได้มีการรวบรวมเนื้อหา สมดุลเคมีซึ้งได้นำมาจาก internet โดยในเนื้อหามีงานสมดุลเคมี กราฟของสมดุลเคมี หรือที่ ต่างๆที่เกี่ยวกันไป โดยที่ผู้นำเสนอก็ยังไม่รู้เลยว่า มันทำยังไงและแบบไหน แต่ก็อุตสาห์ รวบรวมและ นำเสนอมาแล้ว ไงๆ ก็ขอให้ผู้ที่ได้อ่านรายงานเล่มนี้ แล้ว รู้และเข้าใจด้วยนะครับ ขอบคุณครับ N Near โชติช่วง ดีดวงพันธ์ - 3.
สารบัญ สมดุลเคมี 1 คุณสมบัติของสมดุลเคมี 2 ปฏิกิริยาผันกลับได้ 3 ตัวอย่างปฏิกิริยาเคมีที่ผันกลับได้ 4 ข้อสังเกตเกี่ยวกับปฏิกิริยาผันกลับได้ 6 ตัวอย่างโจทย์ หาความสัมพันธ์ของค่าคงที่สมดุล 8 ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล ( K) 13 กราฟของสมดุลเคมี 15 ภาวะสมดุล 16 ค่าคงที่สมดุล 18 อ้างอิง 19 - 4.
สมดุลเคมี สมดุลเคมี คือภาวะสมดุลไดนามิก เกิดเมื่อระบบมีสมบัติคงที่แล้ว แต่ยังคงมีการเปลี่ยนแปลงที่ผันกลับได้ ซึ่งอัตราการเกิดปฏิกิริยาไปข้างหน้า เท่ากับอัตราการเกิดปฏิกิริยาย้อยกลับ สมบัติจึงไม่เปลี่ยนแปลง เช่น . ของเหลว ไอ ร้อนขึ้น เย็นลง - 5.
คุณสมบัติของสมดุลเคมี 1. ต้องเกิดในระบบปิด 2. เกิดการเปลี่ยนแปลงที่ผันกลับได้ 3. ที่ภาวะสมดุลอัตราการเกิดปฏิกิริยาไปข้างหน้าจะเท่ากับ อัตราการเกิดปฏิกิริยาผันกลับ 4. มีสารตั้งต้นเหลืออยู่ทุกสารในระบบ 5. สมบัติของระบบคงที่ - 6.
- 7.
- 8.
- 9.
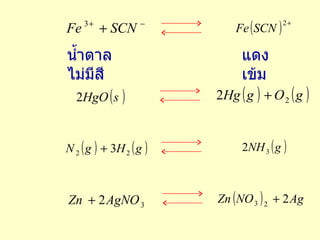
ข้อสังเกตเกี่ยวกับปฏิกิริยาผันกลับได้ 1. เป็นปฏิกิริยาที่สารผลผลิตจากปฏิกิรยาทำปฏิกิร ิ ยากัน ได้ผลผลิตที่เป็นสารผลิตภัณฑ์ 2. ปฏิกิริยาไปข้างหน้า และปฏิกิริยาผันกลับเกิดขึ้นพร้อมกัน 3. ถ้าเริ่มต้นจากปฏิกิริยาด้านใดให้ถือว่าปฏิกิริยานั้นเป็น ปฏิกิริยาไปข้างหน้า 4. เขียนลูกศรคู่ ( ) ในสมการ เพื่อแสดงว่าปฏิกิริยา ผันกลับได้ - 10.
5. พบในปฏิกิริ ยาการสลายตัว ปฏิกิริยารวมตัว และปฏิกิริยา แทนที่ 6. ปฏิกิริยาผันกลับเกิดขึ้นได้หรือไม่นั้นขึ้นอยู่กับภาวะของ ปฏิกิริยา เช่น อุณหภูมิ ความดัน สภาพละลายได้ และค่าคงที่ สมดุลของปฏิกิริยา 7. ปฏิกิริยาจะผันกลับได้มากน้อยเพียงใด ขึ้นอยู่กับค่าคงที่ สมดุลของปฏิกิริยานั้น - 11.
- 12.
----- 1----- 2 ----- 3 จากสมการ 1 กลับสมการแล้วคูณ 3 ----- 4 - 13.
จากสมการ 2 คูณ 2 ----- 5 นำสมการ 4 + 5 จะได้สมการ 3 ดังนั้น - 14.
----- 1----- 2 ----- 3 จากสูตรสมการ 1 คูณ 2 ----- 4 - 15.
จากสมการ 2 กลับสมการ ----- 5 นำสมการ 4 + 5 จะได้สมการ 3 ดังนั้น - 16.
ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล (K) 1. ค่า K จะบอกถึงปฏิกิริยาไปข้างหน้ามากเท่าใด 2. ค่า K จะบอกปริมาณของผลิตภัณฑ์ที่เกิดขึ้น มากน้อยเพียงใด 3. ค่า K ขึ้นอยู่กับอุณหภูมิเท่านั้น ความเข้มข้นและ ความดันไม่มีผล แต่จะมากขึ้นหรือน้อยลงขึ้นกับ ชนิดของปฏิกิริยา 4. ค่า K อาจมีหน่วยหรือไม่มีหน่วยก็ได้ ขึ้นอยู่กับ สมการเคมี - 17.
5. ค่า K มิได้เกี่ยวข้องกับอัตราเร็วในการเกิด ปฏิกิริยา กล่าวคือ ค่า K มาก Rate ของปฏิกิริยา อาจจะเร็วหรือช้าก็ได้ 6. ค่า K อาจมีค่ามากกว่า น้อยกว่าหรือเท่ากับ หนึ่งก็ได้ ขึ้นอยู่กับปฏิกิริยานั้น ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล ( K) - 18.
กราฟของสมดุลเคมี 1. กราฟอัตรากับเวลา X 2 + 2Y 2 2XY 2 อัตราการเกิดปฏิกิริยา เวลา ( s) X 2 + 2Y 2 2XY 2 X 2 + 2Y 2 2XY 2 2XY 2 X 2 + 2Y 2 - 19.
ภาวะสมดุล มีลักษณะดังนี้ 1. ภาวะสมดุลจะเกิดขึ้นได้เมื่อความเข้มข้นของตัวทำปฏิกิรยา และความเข้มข้นของสารผลผลิตในปฏิกิริยาไม่มีการเปลี่ยน แปลงใด ๆ 2. ภาวะสมดุลจะเกิดขึ้นได้ เมื่ออัตราการเกิดปฏิกิริยาไปข้างหน้า เท่ากับอัตราการเกิดปฏิกิรยาผันกลับ - 20.
- 21.
ค่าคงที่สมดุล 1. ที่ภาวะสมดุลเคมีใด ๆ ก็ตามที่อุณหภูมิคงที่ “ ผลคูณความเข้มข้นของผลิตภัณฑ์ยกกำลัง ด้วยสัมประสิทธิ์แสดงจำนวนโมลหารด้วยผลคูณ ความเข้มข้นของสารตั้งต้น ยกกำลังด้วย สัมประสิทธิ์แสดงจำนวนโมลมีค่าเท่ากับ ค่าคงที่สมดุลของปฏิกิริยานั้น ๆ ” - 22.