Recommended
PPT
DOC
PPT
PDF
PPT
PDF
DOC
PDF
DOCX
PPT
ปัจจัยที่มีผลต่อภาวะสมดุล
PPT
PDF
PDF
สื่อการสอน Chemical equilibrium
PPT
PDF
บทที่ 6 อัตราการเกิดปฏิกิริยา
PPT
PDF
PPT
PPT
PPT
DOC
ใบความแนวคิดการเกิดปฏิกิริยา
PPTX
PDF
DOC
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี
PPT
อัตราการเกิดปฏิกิริยาเคมี (Rate of reaction
DOC
PPS
DOC
6 displacement of halogen from its halide solution
PPT
More Related Content What's hot
DOCX
PPT
ปัจจัยที่มีผลต่อภาวะสมดุล
PPT
PDF
PDF
สื่อการสอน Chemical equilibrium
PPT
PDF
บทที่ 6 อัตราการเกิดปฏิกิริยา
PPT
PDF
PPT
PPT
PPT
DOC
ใบความแนวคิดการเกิดปฏิกิริยา
PPTX
PDF
DOC
PDF
เอกสารประกอบการเรียน เรื่อง อัตราการเกิดปฏิกิริยาเคมี
PPT
อัตราการเกิดปฏิกิริยาเคมี (Rate of reaction
DOC
PPS
Viewers also liked
DOC
6 displacement of halogen from its halide solution
PPT
DOCX
AnaChem lab anions (group1-5) reviewer
PPT
PPTX
DOC
PPTX
PPTX
PDF
Vietnam Family Holidays 2013 Travel Hanoi Lao Cai Sapa Ho Chi Minh city Mekon...
PPTX
Il Web del Comune di Udine
PPTX
PDF
North Vietnam Remote Villages Trek and Overland Tour Travel Hanoi Lao Cai Bac...
PDF
Vietnam Cambodia family tour Travel Hanoi Sapa Halong Bay Hoian Nha Trang Sai...
PPTX
Model migration - there and back again (ECE2014)
PDF
Werner Jim Testomony FINAL Nov 2005 Senate EPW Subcommittee on Clean Air
PPS
Personality development notes
PPS
PDF
Similar to สมดุลเคมี
PPT
PPT
สมดุลเคมี ยุวธิดา ดีดวงพันธ์
PPT
สมดุลเคมี โชติช่วง ดีดวงพันธ์
PPT
สมดุลเคมี โชติช่วง ดีดวงพันธ์
PPT
สมดุลเคมี โชติช่วง ดีดวงพันธ์
PPT
สมดุลเคมี วิสุพร ดีดวงพันธ์
PPT
สมดุลเคมี ชินกร ดีดวงพันธ์
PPT
สมดุลเคมี ชินกร ดีดวงพันธ์
PPT
สมดุลเคมี ธวัชชัย รุ่งโรจน์
DOC
DOC
DOC
DOC
DOC
DOC
DOC
DOC
PPTX
PPTX
DOC
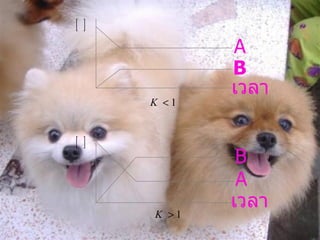
สมดุลเคมี 1. 2. คำนำ ในปัจจุบันนี้การเรียนรู้เรื่องเคมีมีความสำคัญใน ชีวิตประจำวันและใช้ในการศึกษา ค้นคว้าและยังใช้ในการทำผลิตภัณฑ์ต่างๆ อย่างเช่น สบู่ แชมพู ฯลฯ รายงานนี้ผู้จัดทำได้ทำขึ้นมาเพื่อ เป็นสื่อในการเรียนการสอน อีกรูปแบบหนึ่งซึ่งหวังว่า ผู้อ่านคงจะเข้าใจเรื่องนี้เป็นอย่างมากเพราะเป็นเรื่องที่ใช้กันในชีวิตประจำวัน กมลมาตย์ 3. 4. สมดุลเคมี สมดุลเคมี คือ ภาวะสมดุลไดนามิก เกิดเมื่อระบบมีสมบัติคงที่แล้ว แต่ยังคงมีการเปลี่ยนแปลงที่ผันกลับได้ ซึ่งอัตราการเกิดปฏิกิริยาไปข้างหน้า เท่ากับอัตราการเกิดปฏิกิริยาย้อยกลับ สมบัติจึงไม่เปลี่ยนแปลง เช่น . ของเหลว ไอ ร้อนขึ้น เย็นลง 5. คุณสมบัติของสมดุลเคมี 1. ต้องเกิดในระบบปิด 2. เกิดการเปลี่ยนแปลงที่ผันกลับได้ 3. ที่ภาวะสมดุลอัตราการเกิดปฏิกิริยาไปข้างหน้าจะเท่ากับ อัตราการเกิดปฏิกิริยาผันกลับ 4. มีสารตั้งต้นเหลืออยู่ทุกสารในระบบ 5. สมบัติของระบบคงที่ 6. 7. 8. 9. ข้อสังเกตเกี่ยวกับปฏิกิริยาผันกลับได้ 1. เป็นปฏิกิริยาที่สารผลผลิตจากปฏิกิรยาทำปฏิกิร ิ ยากัน ได้ผลผลิตที่เป็นสารผลิตภัณฑ์ 2. ปฏิกิริยาไปข้างหน้า และปฏิกิริยาผันกลับเกิดขึ้นพร้อมกัน 3. ถ้าเริ่มต้นจากปฏิกิริยาด้านใดให้ถือว่าปฏิกิริยานั้นเป็น ปฏิกิริยาไปข้างหน้า 4. เขียนลูกศรคู่ ( ) ในสมการ เพื่อแสดงว่าปฏิกิริยา ผันกลับได้ 10. 5. พบในปฏิกิร ิ ยาการสลายตัว ปฏิกิริยารวมตัว และปฏิกิริยา แทนที่ 6. ปฏิกิริยาผันกลับเกิดขึ้นได้หรือไม่นั้นขึ้นอยู่กับภาวะของ ปฏิกิริยา เช่น อุณหภูมิ ความดัน สภาพละลายได้ และค่าคงที่ สมดุลของปฏิกิริยา 7. ปฏิกิริยาจะผันกลับได้มากน้อยเพียงใด ขึ้นอยู่กับค่าคงที่ สมดุลของปฏิกิริยานั้น 11. ภาวะสมดุล มีลักษณะดังนี้ 1. ภาวะสมดุลจะเกิดขึ้นได้เมื่อความเข้มข้นของตัวทำปฏิกิรยา และความเข้มข้นของสารผลผลิตในปฏิกิริยาไม่มีการเปลี่ยน แปลงใด ๆ 2. ภาวะสมดุลจะเกิดขึ้นได้ เมื่ออัตราการเกิดปฏิกิริยาไปข้างหน้า เท่ากับอัตราการเกิดปฏิกิรยาผันกลับ 12. 13. ค่าคงที่สมดุล 1. ที่ภาวะสมดุลเคมีใด ๆ ก็ตามที่อุณหภูมิคงที่ “ ผลคูณความเข้มข้นของผลิตภัณฑ์ยกกำลัง ด้วยสัมประสิทธิ์แสดงจำนวนโมลหารด้วยผลคูณ ความเข้มข้นของสารตั้งต้น ยกกำลังด้วย สัมประสิทธิ์แสดงจำนวนโมลมีค่าเท่ากับ ค่าคงที่สมดุลของปฏิกิริยานั้น ๆ ” 14. 15. 16. 17. 18. 19. 20. 21. 22. ----- 1 ----- 2 ----- 3 จากสมการ 1 กลับสมการแล้วคูณ 3 ----- 4 23. จากสมการ 2 คูณ 2 ----- 5 นำสมการ 4 + 5 จะได้สมการ 3 ดังนั้น 24. ----- 1 ----- 2 ----- 3 จากสูตรสมการ 1 คูณ 2 ----- 4 25. จากสมการ 2 กลับสมการ ----- 5 นำสมการ 4 + 5 จะได้สมการ 3 ดังนั้น 26. ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล ( K) 1. ค่า K จะบอกถึงปฏิกิริยาไปข้างหน้ามากเท่าใด 2. ค่า K จะบอกปริมาณของผลิตภัณฑ์ที่เกิดขึ้น มากน้อยเพียงใด 3. ค่า K ขึ้นอยู่กับอุณหภูมิเท่านั้น ความเข้มข้นและ ความดันไม่มีผล แต่จะมากขึ้นหรือน้อยลงขึ้นกับ ชนิดของปฏิกิริยา 4. ค่า K อาจมีหน่วยหรือไม่มีหน่วยก็ได้ ขึ้นอยู่กับ สมการเคมี 27. 5. ค่า K มิได้เกี่ยวข้องกับอัตราเร็วในการเกิด ปฏิกิริยา กล่าวคือ ค่า K มาก Rate ของปฏิกิริยา อาจจะเร็วหรือช้าก็ได้ 6. ค่า K อาจมีค่ามากกว่า น้อยกว่าหรือเท่ากับ หนึ่งก็ได้ ขึ้นอยู่กับปฏิกิริยานั้น ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล ( K) 28. 29. 30. 31. 32. 33. ตัวอย่างที่ 2 อุณหภูมิหนึ่งก๊าซ HI 1 โมลต่อลิตร สลายตัว 2 HI H 2 (g) + I 2 (g) จงคำนวณหาค่า คงที่สมดุล วิธีทำ ก๊าซ HI 1 โมลต่อลิตร สลายตัว 20 % ก๊าซ HI สลายตัว = 34. เดิม - - - สมดุล 1- 0.2 0.1 0.1 ค่าคงที่สมดุล =1.56 X 10 -2 35. 36. 37. 38. 39. 40.













![จากสมการ เมื่อกำหนด [ ] แทนความเข้มข้นของสาร , K คือค่าคงที่สมดุลจะได้ว่า](https://image.slidesharecdn.com/random-100830222102-phpapp02/85/slide-14-320.jpg)