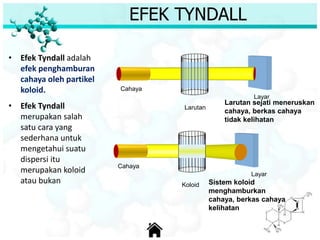
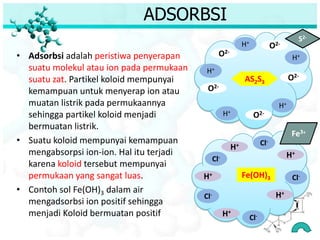
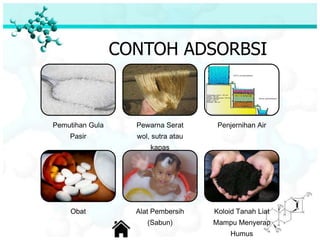
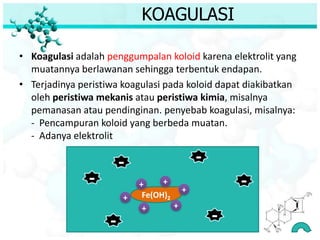
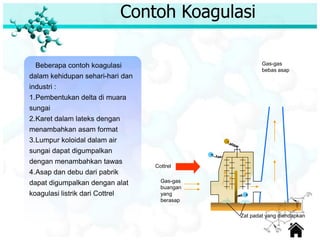
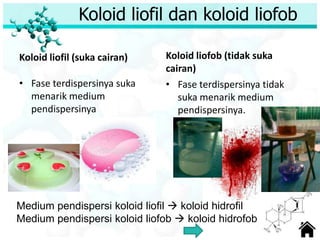
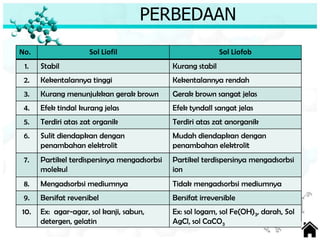
Dokumen ini membahas tentang sifat, pembuatan, dan perilaku koloid, termasuk efektivitas Tyndall, gerak Brown, elektroforesis, adsorbsi, koagulasi, dan dialisis. Koloid dibedakan menjadi liofil (suka cairan) dan liofob (tidak suka cairan), serta proses pembuatan koloid yang meliputi kondensasi dan dispersi. Berbagai contoh aplikasi dan metode pembuatan koloid juga diuraikan.