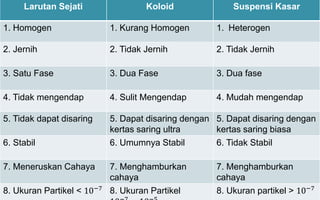
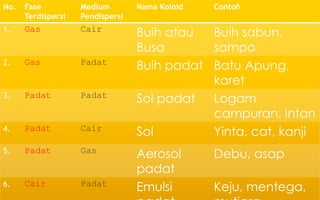
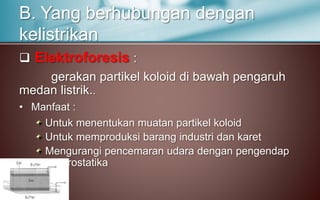
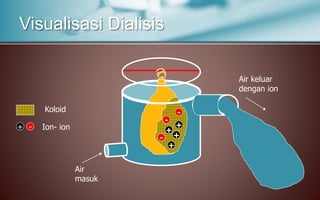
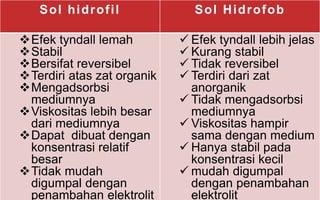
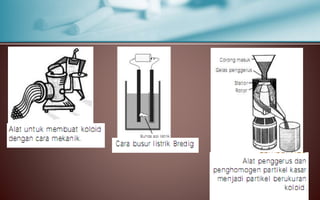
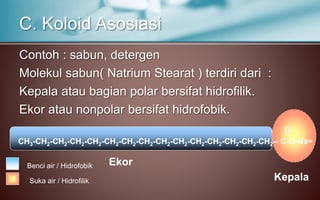
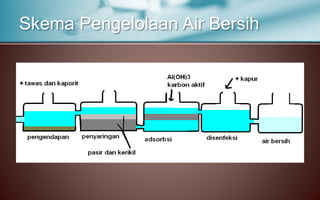
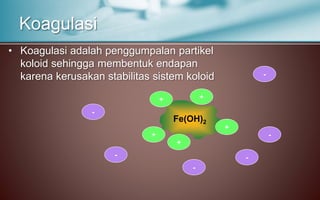
Dokumen tersebut membahas tentang koloid, yaitu sistem dispersi dengan ukuran partikel 1-100 nm. Terdapat tiga jenis dispersi yakni larutan, koloid, dan suspensi. Koloid memiliki sifat seperti efek Tyndall, gerak Brown, elektroforesis, dan dialisis. Ada tiga cara pembuatan koloid yaitu kondensasi, dispersi, dan asosiasi. Kestabilan koloid dipengaruhi oleh muatan listrik pada permukaan partikelnya.