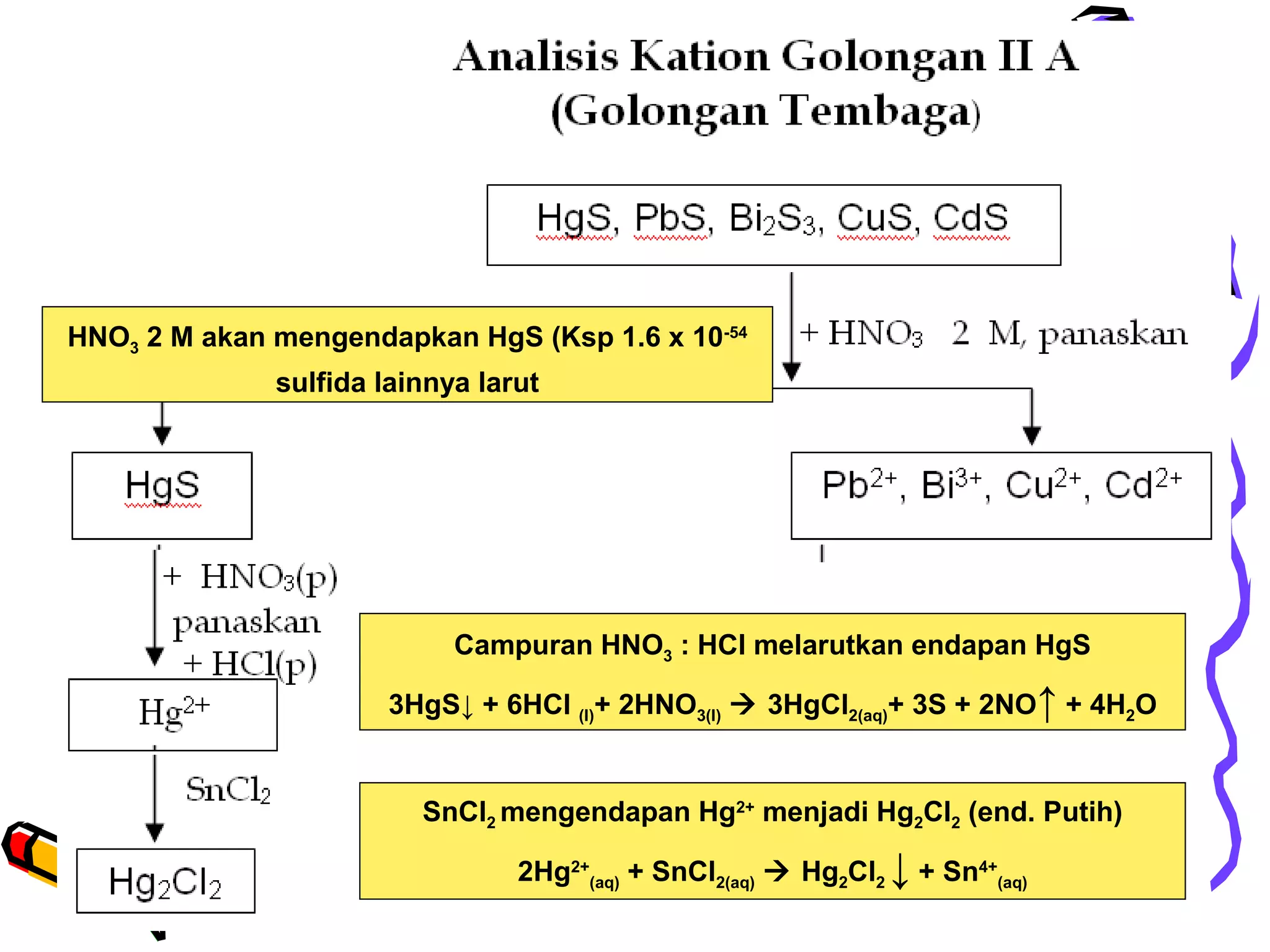
Dokumen ini menjelaskan prosedur pemisahan kation golongan II dan IV melalui reaksi dengan HCl dan H2S, di mana kondisi keasaman harus diatur untuk mengendapkan ion tertentu. Pemisahan dilakukan dengan sentrifugasi dan pengujian menggunakan indikator serta reagen untuk mengkonfirmasi keberadaan kation seperti Bi, Cu, dan Cd. Prosedur juga mencakup penghilang kation Cu menggunakan natrium ditionit dan teknik pengujian lanjutan untuk arsenit dan arsenat.

![IIA
IIB
Golongan IIA,B
Pb2+, Hg2+, Bi3+, Cu2+, Cd2+
As3+,5+, Sb3+,5+, Sn2+,4+
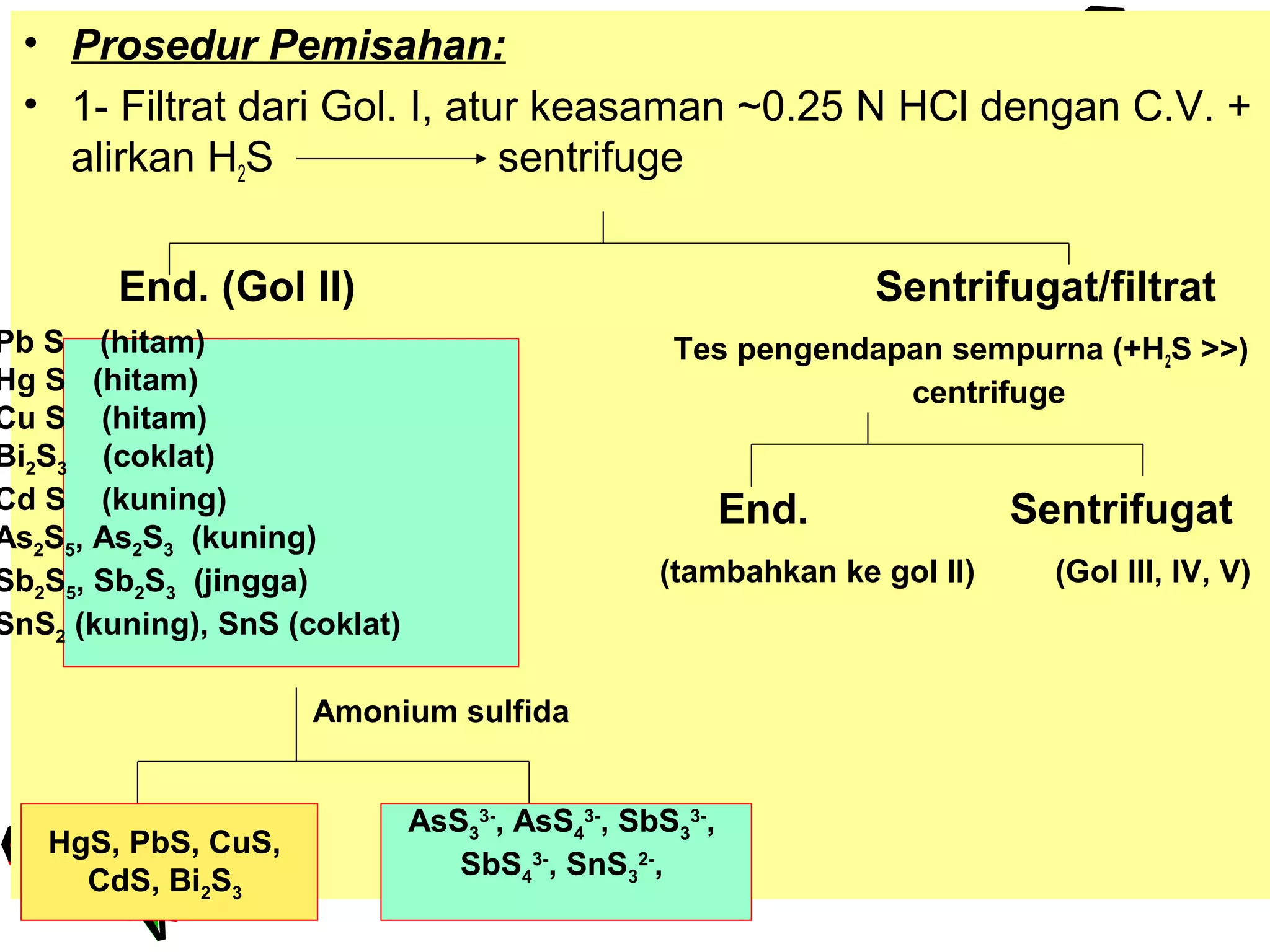
• “ Golongan Asam Sulfida”
• Pereaksi golongan : HCl + H2S
• Sulfida dari Gol. II dan Gol. IV keduanya tidak larut air. Tetapi
Gol. IV memiliki Ksp yang tinggi (membutuhkan [S-2] tinggi
untuk mengendapkannya)
• Untuk mengendapkan Gol. II hanya digunakan HCl & H2S
• (asam kuat) HCl
H + + Cl- (ionisasi sempurna)
2H+ + S-2 (ionisasi sebagian)
• ( asam lemah) H2S
•
efek ion sejenis
• Adanya efek ion sejenis, Ionisasi H2S berkurang, sehingga
konsentrasi ion S-2 rendah dan cukup untuk mengendapkan Gol.
II(Ksp Gol II rendah, mudah terlampaui) tetapi tidak cukup](https://image.slidesharecdn.com/pemisahankationgol-140104184036-phpapp02/75/Pemisahan-kation-gol-ii-2-2048.jpg)


![Pb2+ mengendap, Ksp PbSO4 kecil
End. putih
PbSO4 ↓+ 4CH3COO-
[Pb(CH3COO)4]2-+ SO42-
Lar. biru
Reaksi
End. kuning
End. hitam](https://image.slidesharecdn.com/pemisahankationgol-140104184036-phpapp02/75/Pemisahan-kation-gol-ii-7-2048.jpg)
![•
Konfirmasi Bismuth (Bi+3) :-
•
1- Bi(OH)3 (end.putih) + alkali stannit ( SnCl2 + NaOH berlebih)
•
•
SnCl2 + NaOH
•
Sn(OH)2 ↓ + NaCl
•
Sn(OH)2 + NaOH >>
end putih
NaHSnO2 alkali stannit
•
2 Bi(OH)3↓ + 3 [HSnO2]-
2Bi0↓+ 3 [HSnO3]- + 3 H2O
end. hitam](https://image.slidesharecdn.com/pemisahankationgol-140104184036-phpapp02/75/Pemisahan-kation-gol-ii-8-2048.jpg)

![•
•
•
•
•
•
•
•
•
•
•
•
•
•
Konfirmasi (Cu2+) dan (Cd2+) :
Pada filtrat setelah penambahan NH3 [ kompeks amina Cu (Lar. biru) dan Cd
(tak berwarna)]
Cu dapat di uji dengan adanya Cd tetapi tidak sebaliknya, karena Cu
bereaksi dengan semua uji untuk Cd.
Prosedur sianida :Bagi dua larutan menjadi 2 :
The smaller portion :- Tes Cu2+
1- Asamkan dengan asam asetat + Kalium ferrosianida
Cu2++ [Fe(CN)6]4Cu2[Fe(CN)6] end cokat kemerahan
N.B. Asam asetat mendisosiasi kompleks amina Cu
[Cu(NH3)4]2+ + CH3COOH
Cu(CH3COO)2 + NH3
2- larutan + KI
2Cu2+ + 4 ICu2I2↓ +
I2
end putih
larutan coklat
3- larutan + KCNS
Cu2+ + CNSCu(SCN)2
End hitam](https://image.slidesharecdn.com/pemisahankationgol-140104184036-phpapp02/75/Pemisahan-kation-gol-ii-10-2048.jpg)


