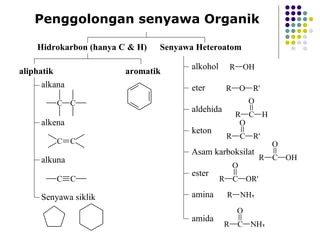
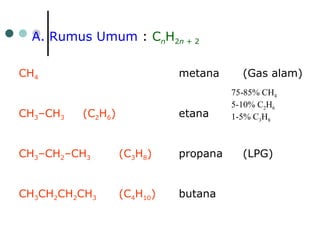
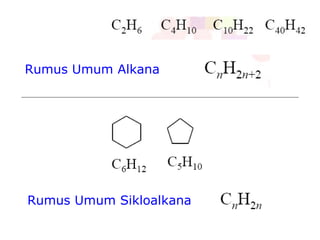
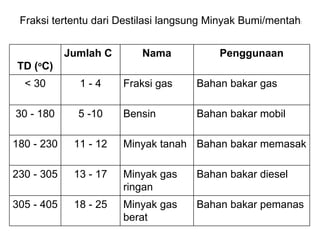
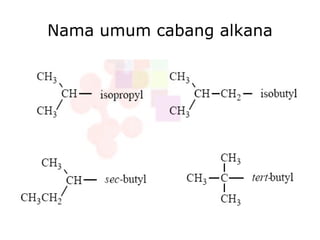
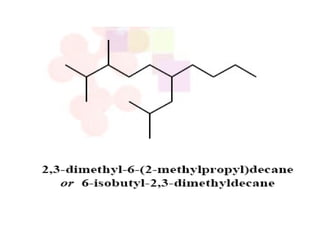
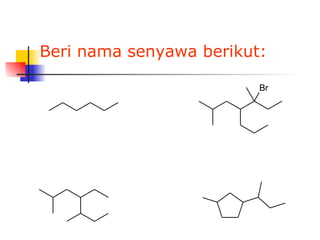
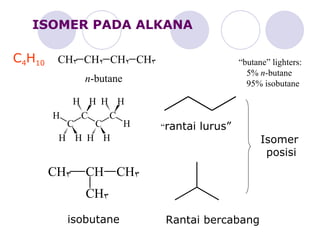
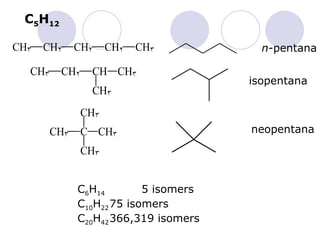
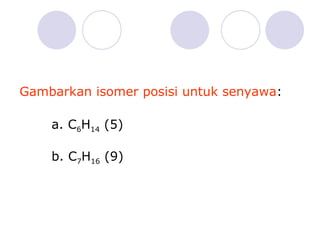
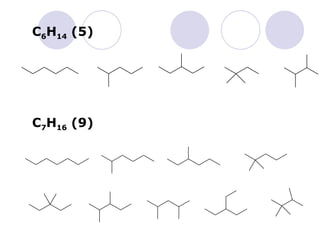
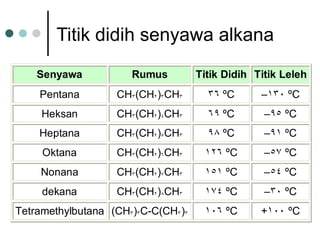
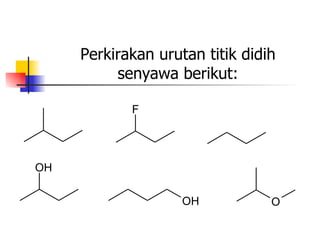
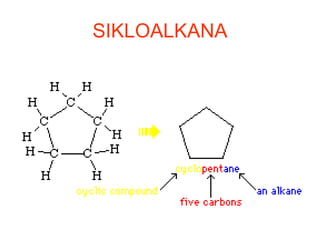
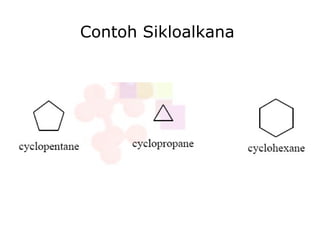
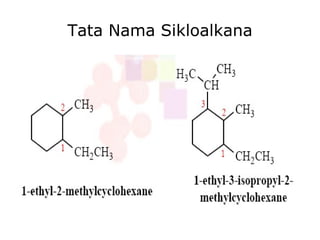
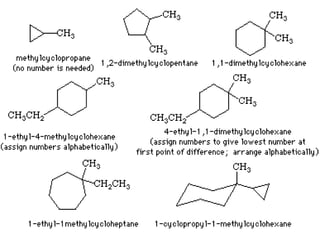
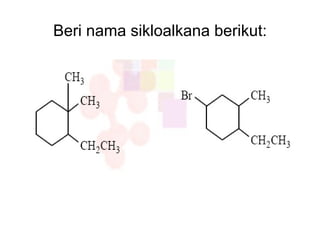
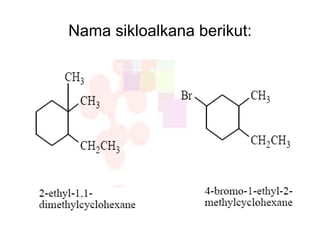
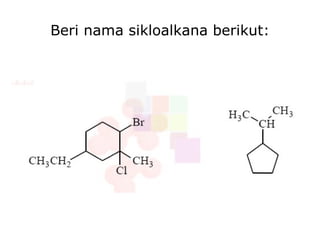
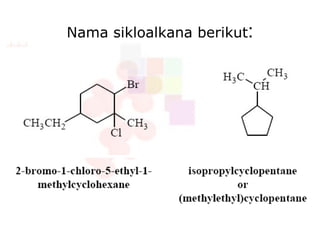
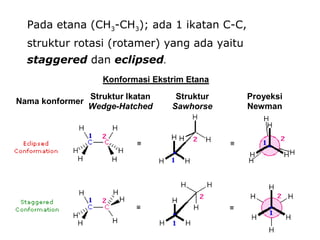
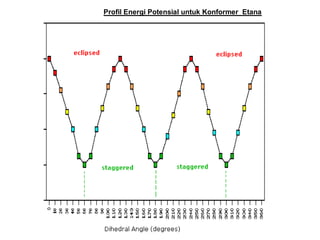
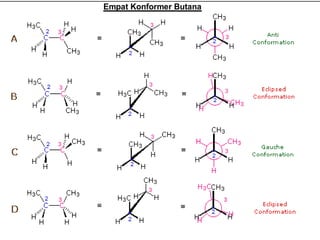
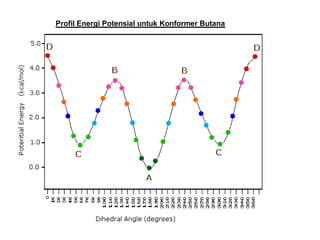
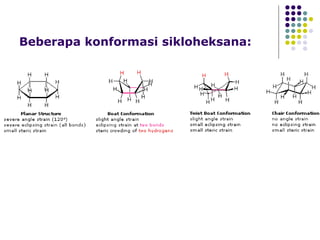
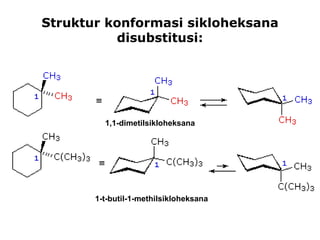
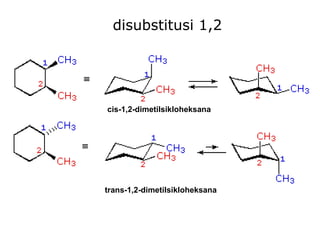
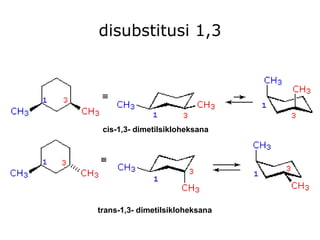
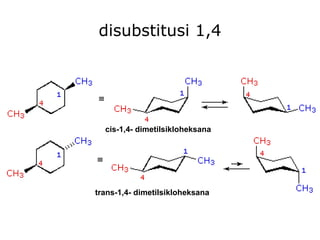
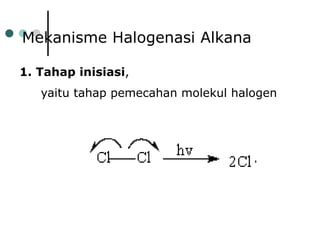
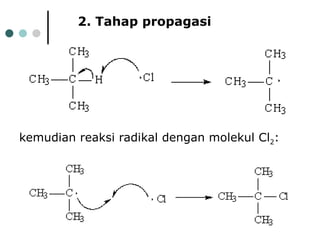
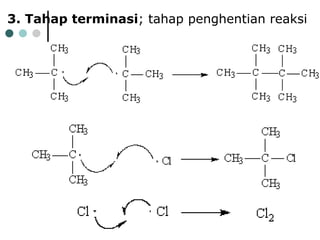
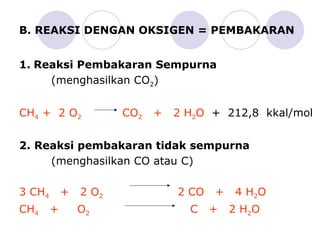
Dokumen tersebut membahas tentang alkana dan sikloalkana. Menguraikan struktur, penamaan, sifat fisika, dan reaksi kimia dari senyawa-senyawa tersebut. Termasuk penjelasan mengenai isomer, konformasi pada alkana dan sikloalkana, serta reaksi halogenasi dan pembakaran alkana.