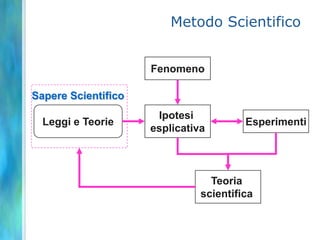
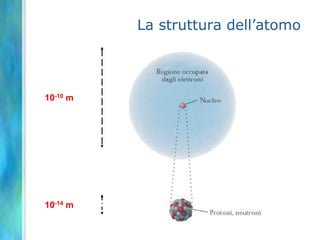
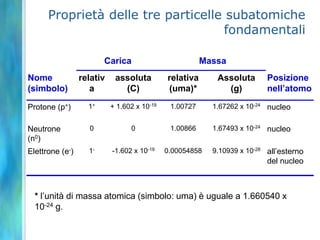
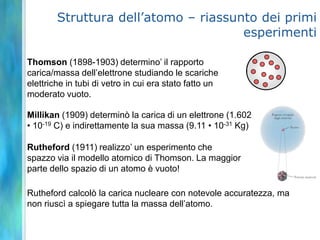
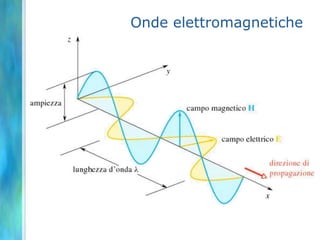
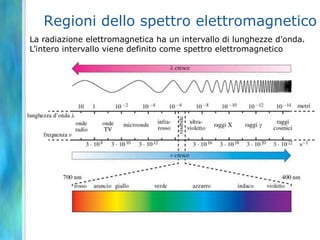
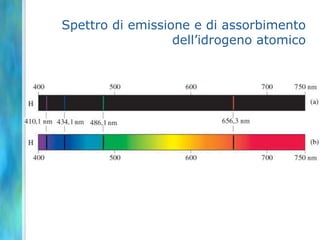
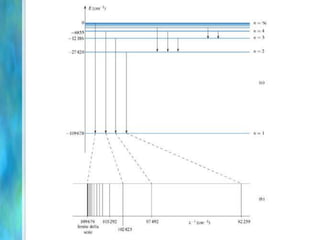
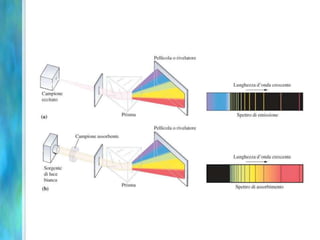
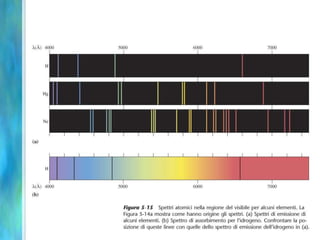
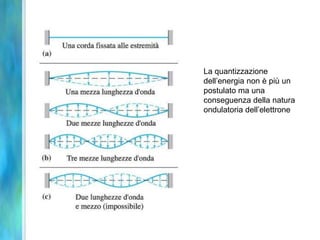
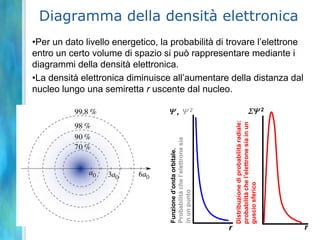
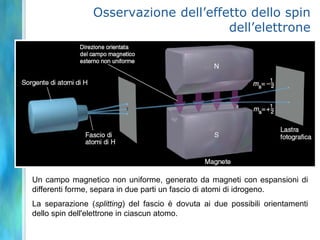
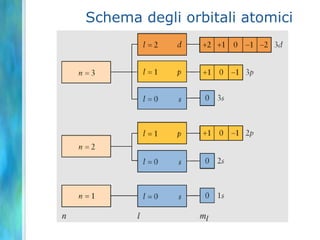
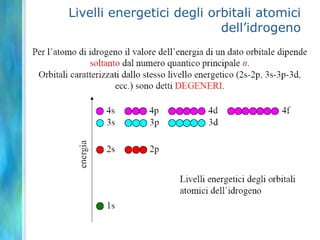
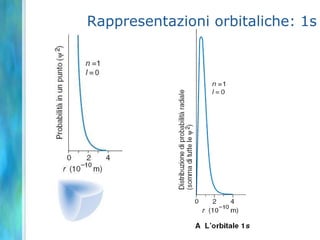
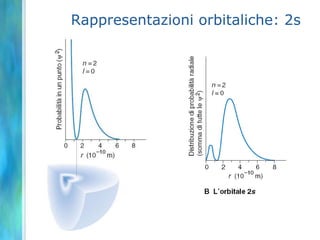
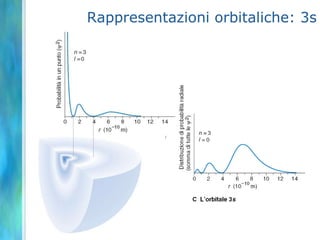
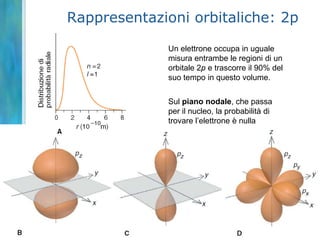
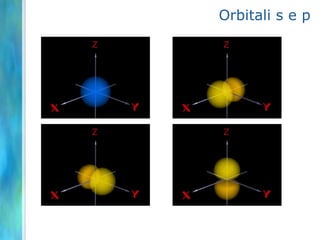
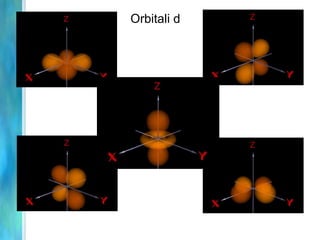
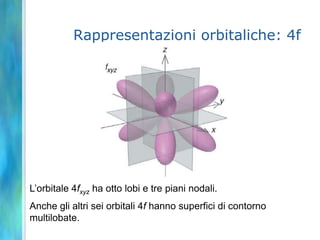
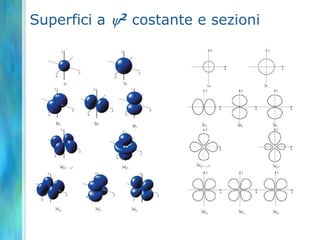
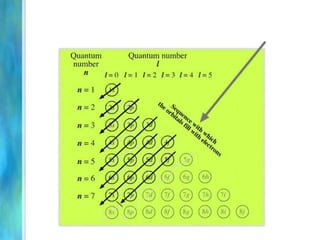
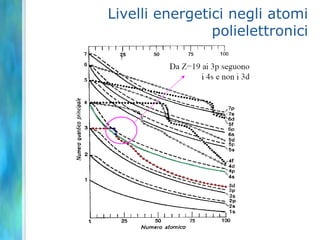
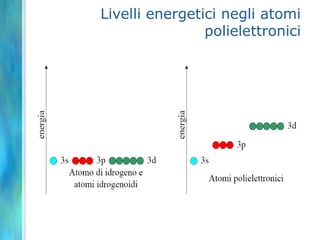
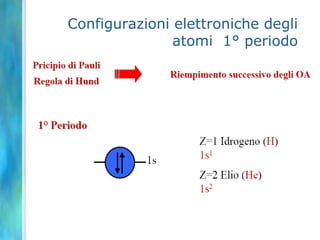
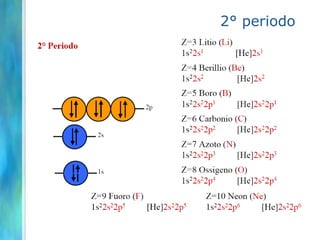
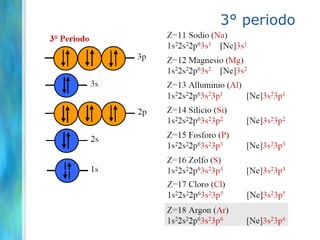
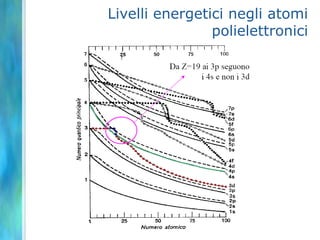
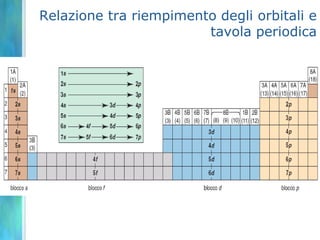
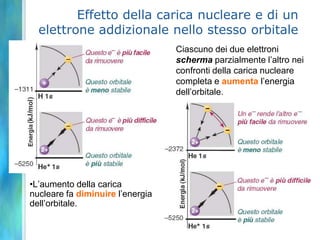
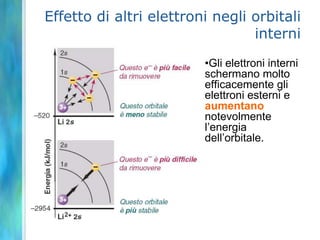
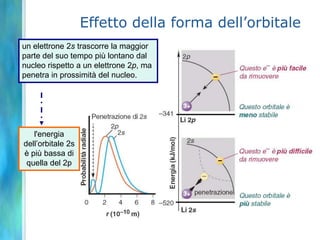
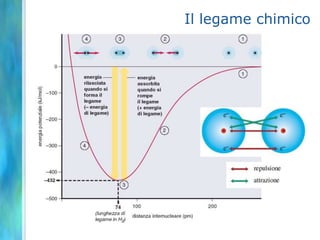
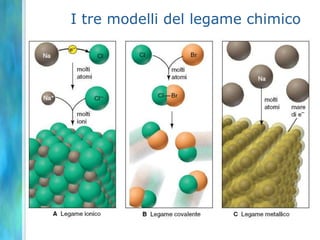
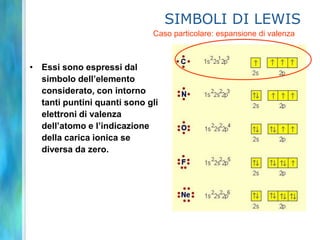
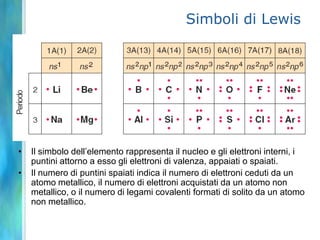
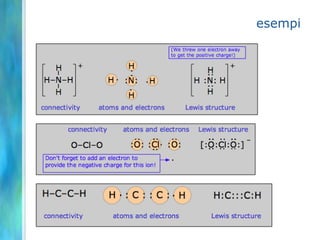
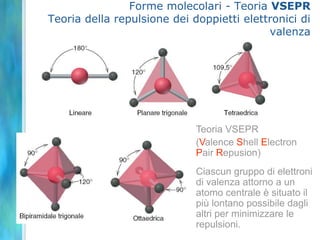
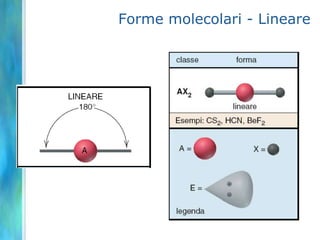
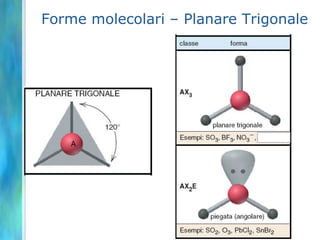
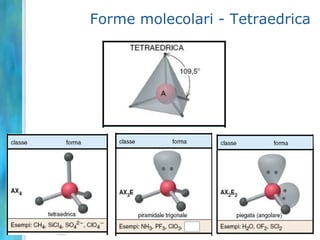
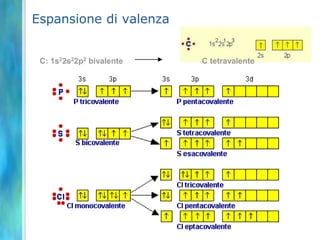
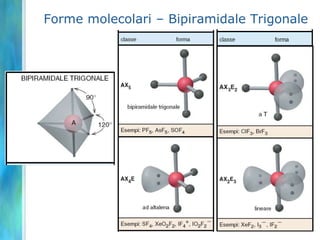
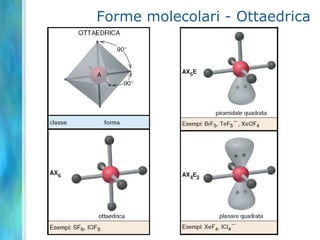
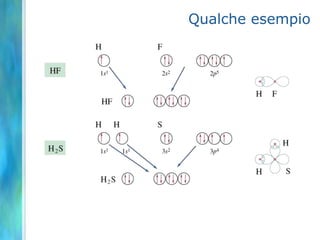
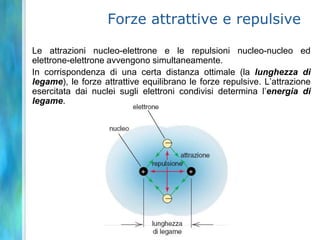
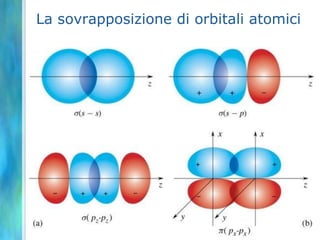
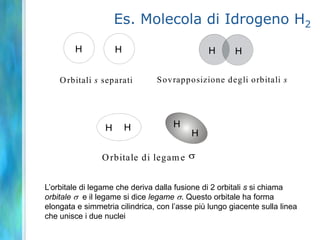
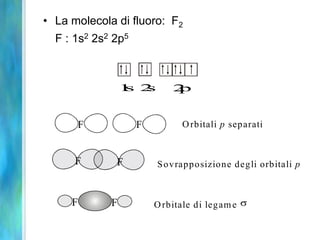
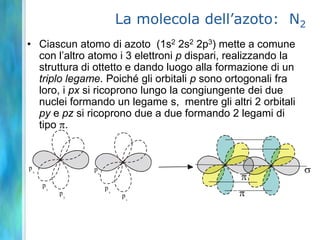
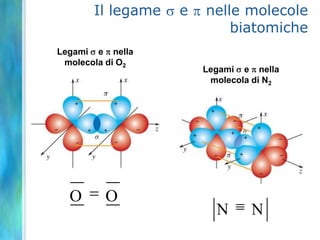
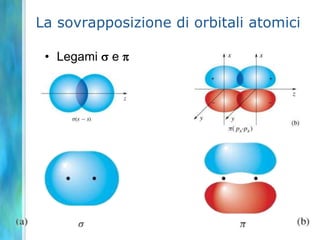
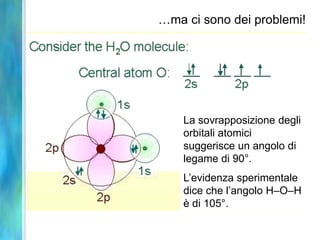
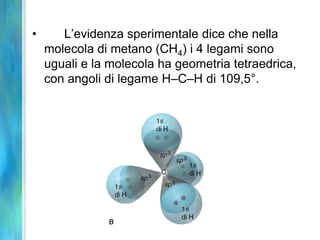
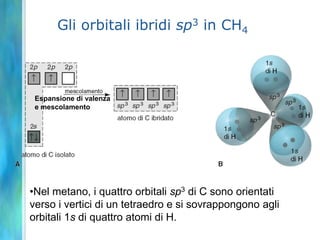
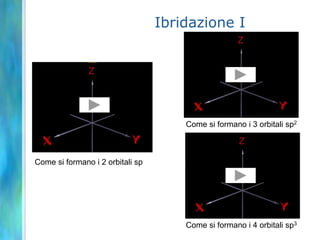
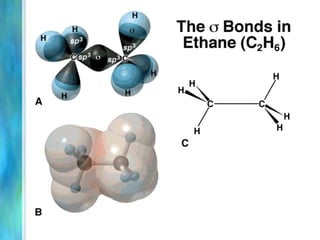
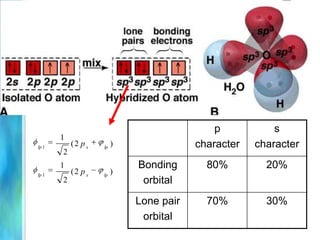
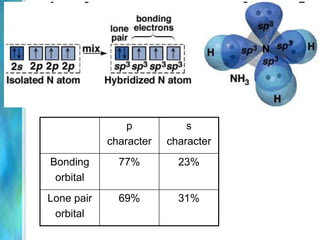
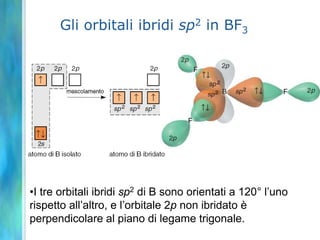
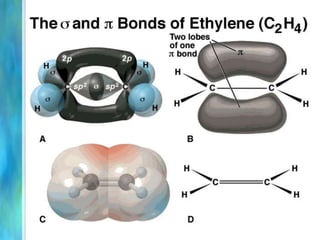
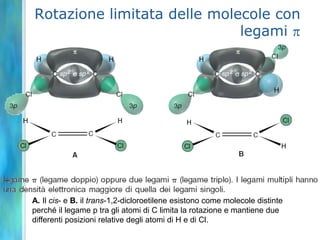
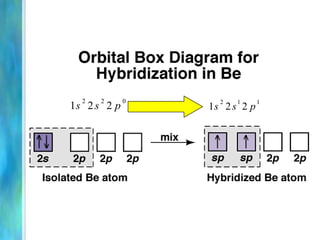
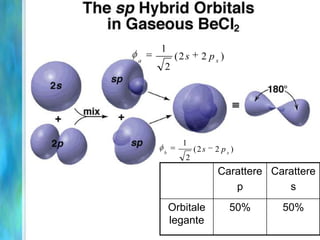
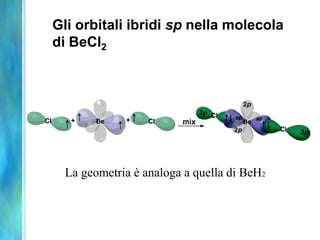
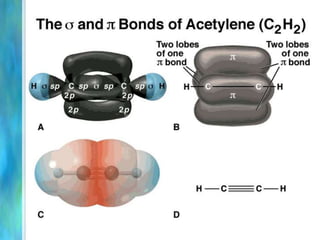
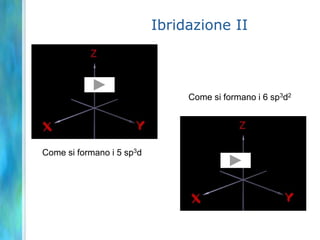
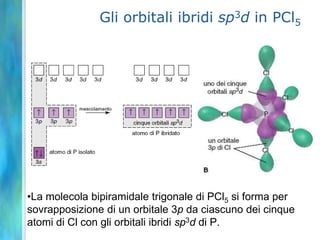
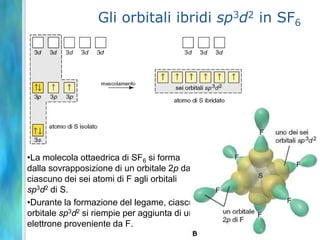
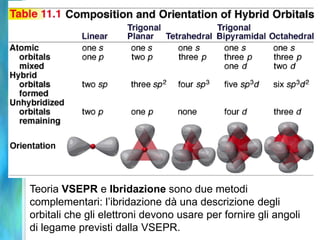
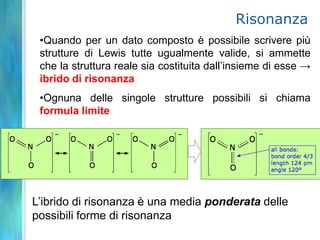
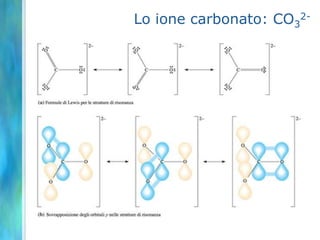
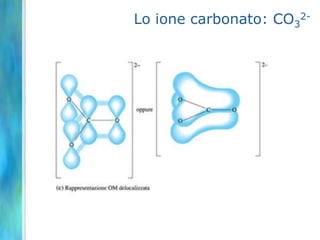
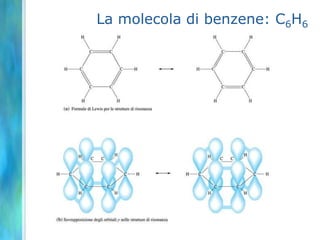
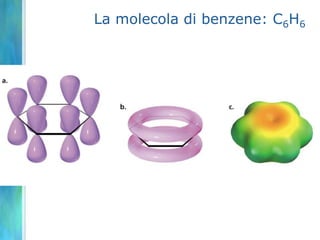
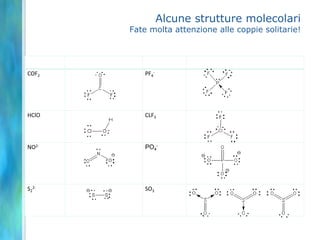
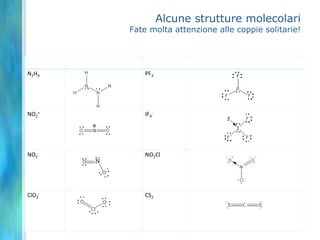
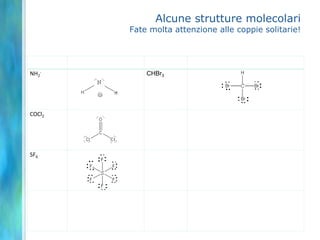
Il documento tratta le teorie atomiche, la configurazione elettronica e il legame chimico, coprendo esperimenti storici e modelli atomici da Thomson a Schrödinger. Viene discusso il dualismo onda-particella, la quantizzazione dell'energia e il concetto di orbitali atomici, con l'inclusione di numeri quantici. Si conclude con la descrizione delle configurazioni elettroniche secondo il principio di Aufbau e la regola di Pauli.