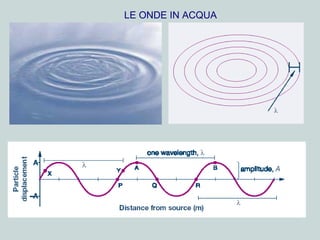
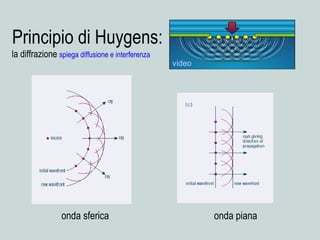
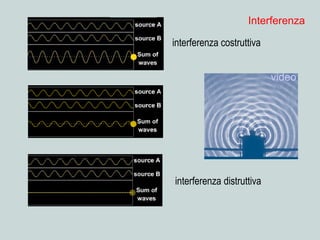
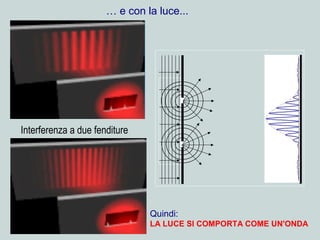
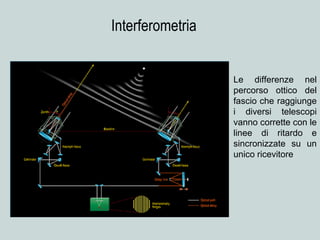
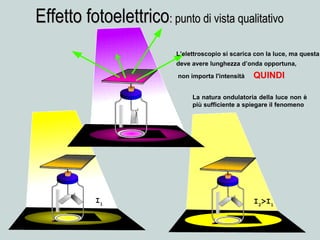
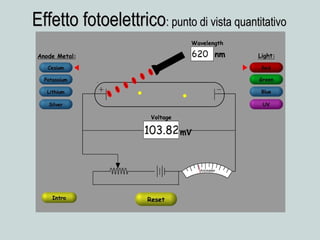
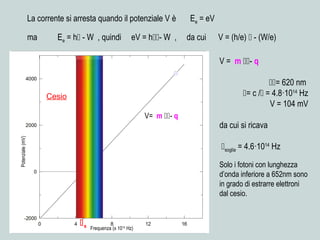
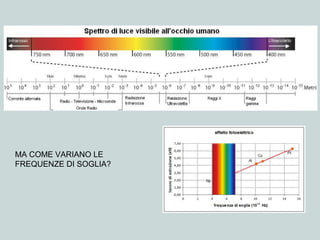
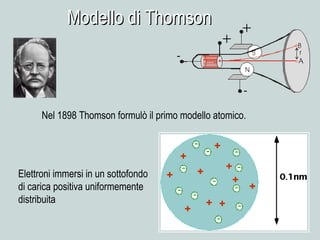
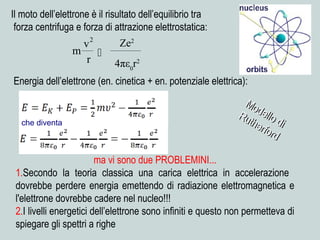
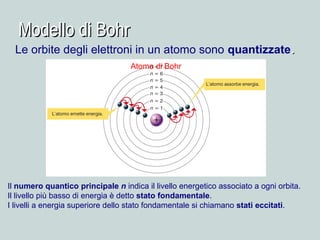
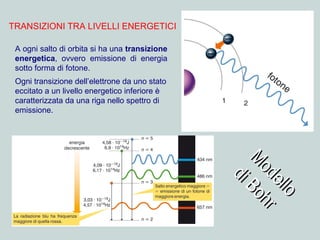
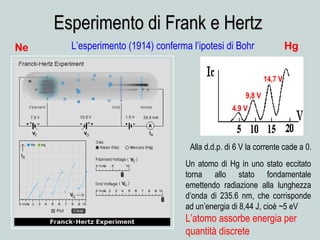
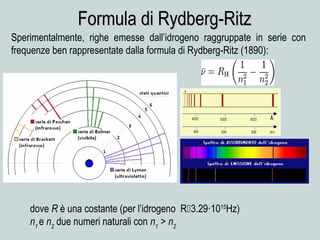
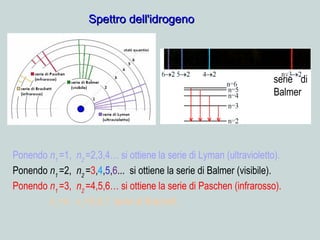
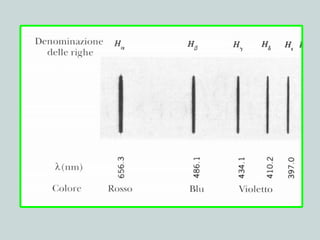
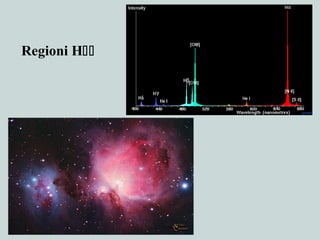
Il documento discute la natura della luce e il suo comportamento sia come onda che come particella. Viene trattata l'interferenza, il principio di Huygens, l'effetto fotoelettrico e vari modelli atomici, con particolare attenzione al modello di Bohr. Inoltre, sono presentate le transizioni energetiche degli elettroni e le righe spettrali associate agli spettri di emissione degli atomi.