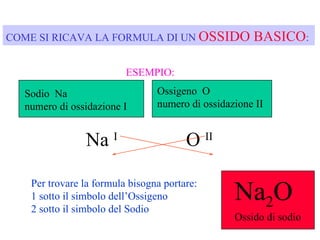
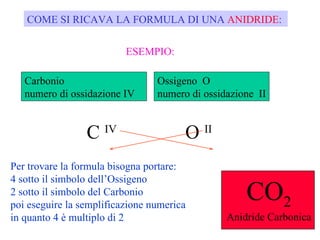
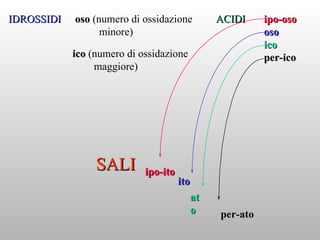
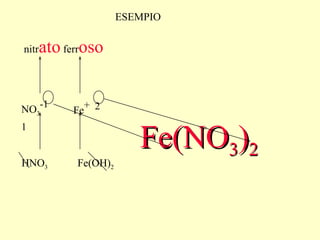
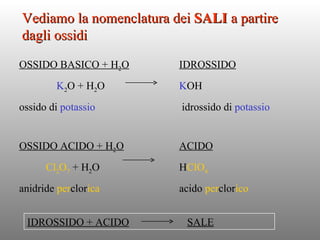
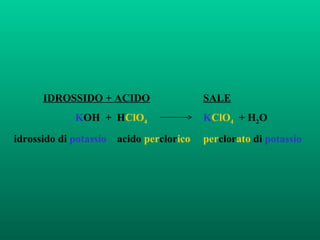
Il documento tratta della nomenclatura dei composti inorganici in chimica, spiegando come determinare le formule di ossidi, anidridi, idrossidi e sali attraverso i numeri di ossidazione degli elementi chimici. Vengono forniti esempi pratici per calcolare le formule chimiche e come i diversi stati di ossidazione influenzano la nomenclatura. La guida è utile per comprendere le reazioni tra idrossidi e acidi e per identificare gli anioni risultanti dai sali.