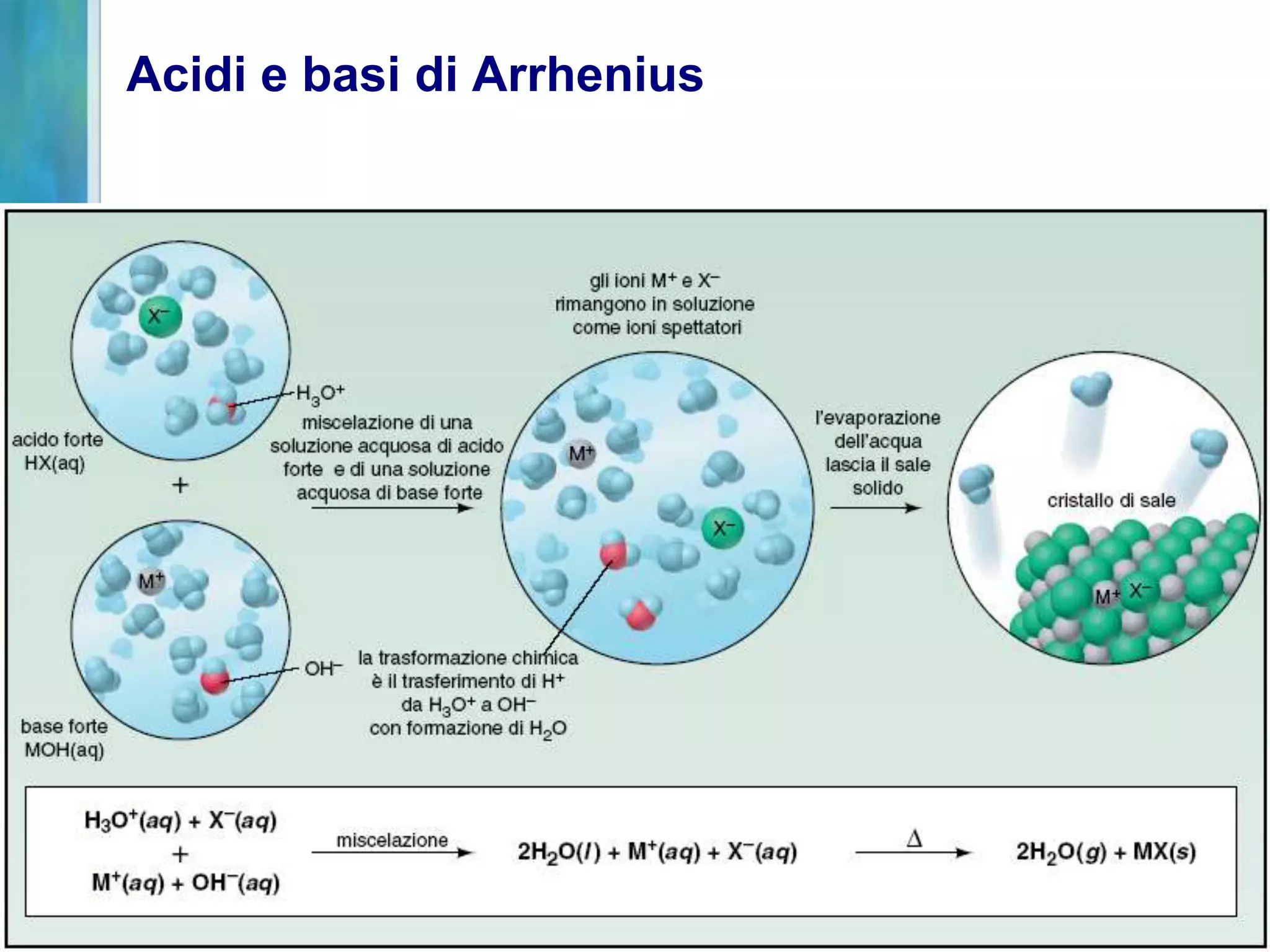
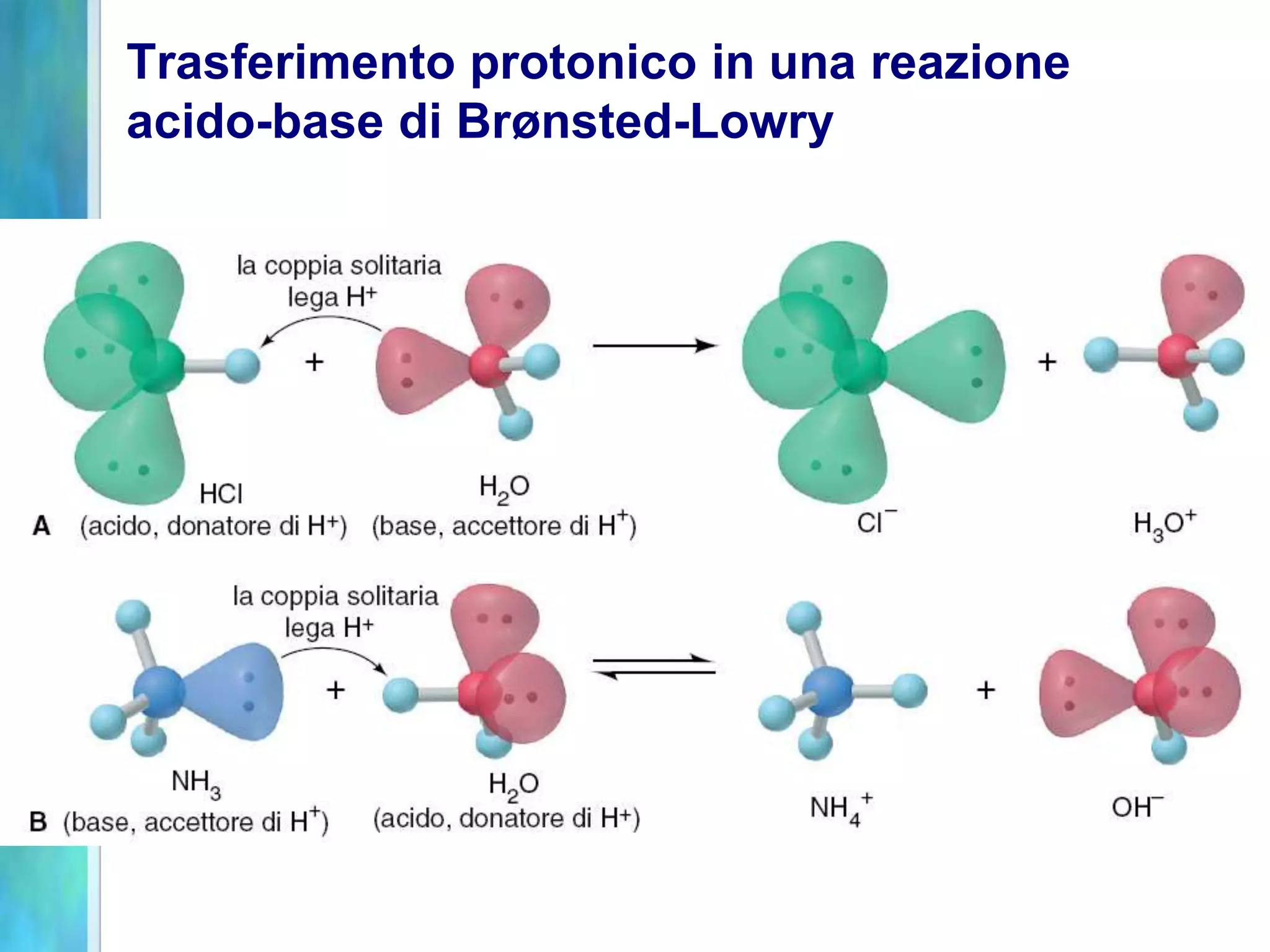
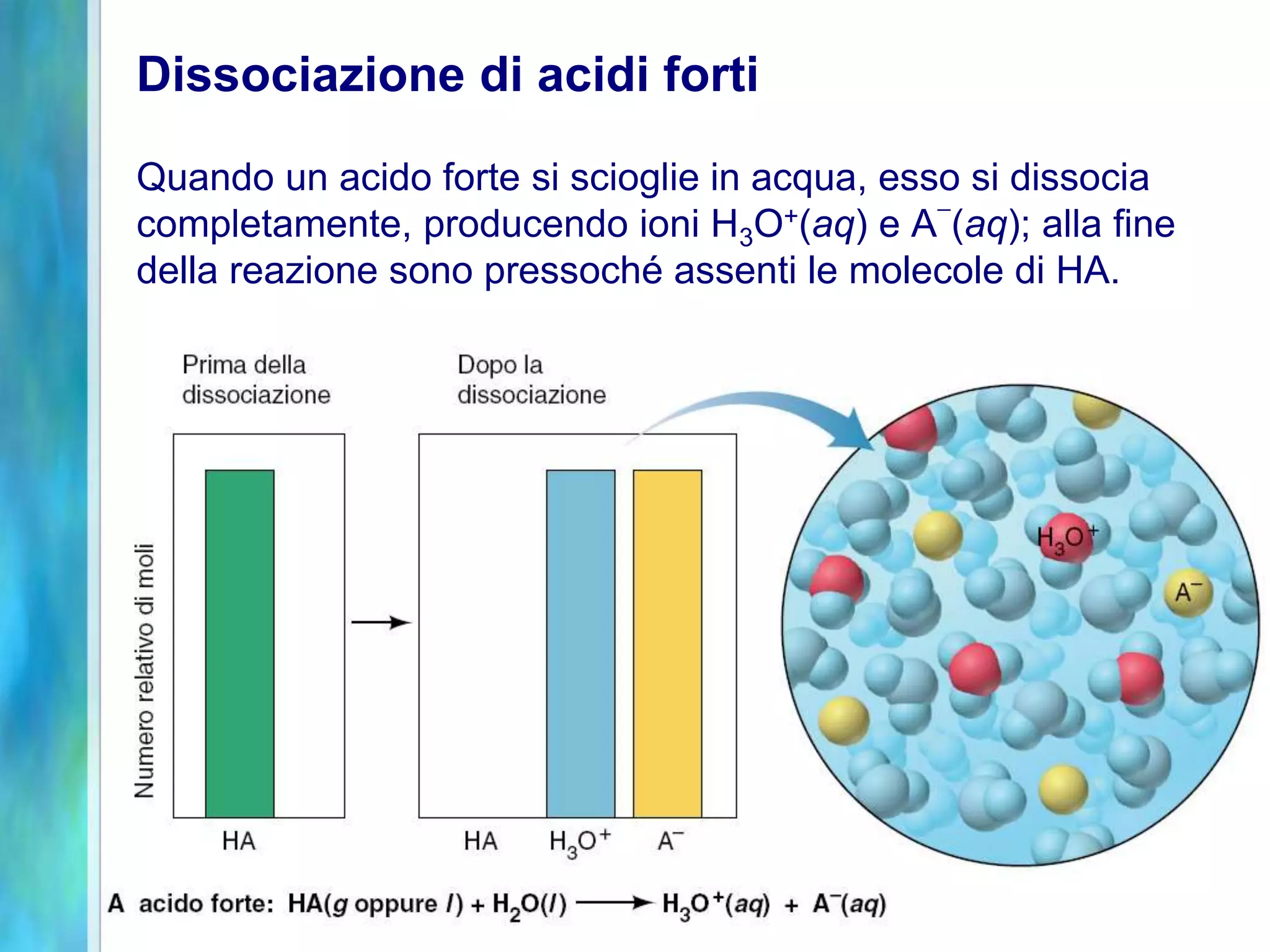
Il documento tratta gli acidi e le basi, descrivendo le definizioni di Arrhenius, Brønsted-Lowry e Lewis, nonché la dissociazione di acidi forti e deboli. Analizza anche le proprietà di solubilità, le costanti di dissociazione acida e basica, e le soluzioni tampone, fornendo esempi e relazioni tra pH, pOH e concentrazioni. Infine, discute l'idrolisi dei sali e le condizioni che determinano l'acidità o la basicità delle soluzioni.












![La costante di dissociazione acida Ka
Poiché le variazioni di concentrazione di H2O a seguito della
dissociazione di HA sono trascurabili, ossia [H2O] ≈ costante, si
può definire una nuova costante di equilibrio, detta costante di
dissociazione acida (o costante di ionizzazione acida) Ka:
HA (aq) + H2O(l) ⇄ A-
(aq) + H3O+
(aq)
]
][
[
]
[
]
[
2
3
O
H
HA
O
H
A
-
KC
]
[
]
[
]
[
]
[ 3
2
HA
O
H
A
O
H
-
K
K a
C
Ka dipende dalla temperatura e indica la posizione dell’equilibrio
della reazione: acido più forte → [H3O+] più alta → Ka maggiore](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-16-2048.jpg)
![HClO2 (aq) + H2O (l) ⇄ ClO2
-
(aq) + H3O+
(aq)
]
HClO
[
]
O
H
[
]
ClO
[
2
3
2
a
-
K
N2H2 (aq) + H2O (l) ⇄ N2H3
+
(aq) + OH-
(aq)
]
H
N
[
]
OH
[
]
H
N
[
2
2
3
2
b
-
K
Costante di dissociazione acida e basica](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-17-2048.jpg)
![Autoprotolisi dell’acqua
Kw
(25°C) = [H3O+] · [OH-] = 1.0·10-14
Costante di autoprotolisi dell’acqua](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-18-2048.jpg)
![2 H2O(l) ⇄ H3O+
(aq) + OH-
(aq)
A 25°C si ha Kw = 10-14
Soluzione neutra: [H3O+] = [OH-]
Soluzione acida: [H3O+] > [OH-]
Soluzione basica: [H3O+] < [OH-]
]
[
]
[
K 3
-
OH
O
H
w
Kw =Prodotto ionico dell’acqua](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-19-2048.jpg)
![Soluzione neutra:
Soluzione acida:
Soluzione basica:
w
3 ]
OH
[
]
O
H
[ K
-
w
w OH
;
O
H K
]
[
K
]
[ 3
-
]
OH
[
]
O
H
[ 3
w
-
K
w
w
3 ]
OH
[
;
]
O
H
[ K
K
-
](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-20-2048.jpg)
![a T = 25°C
100 10-2 10-4 10-6
10-1 10-3 10-5 10-7 10-8 10-10 10-12 10-14
10-9 10-11 10-13
soluzione acida soluzione basica
soluzione
neutra
Kw
[H3O+] > [OH-] [H3O+] < [OH-]
[H3O+]
[H3O+] > 10-7
[OH-] < 10-7
[H3O+] < 10-7
[OH-] > 10-7
[H3O+] = [OH-] = 10-7](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-21-2048.jpg)
![a T = 25°C
100 10-2 10-4 10-6
10-1 10-3 10-5 10-7 10-8 10-10 10-12 10-14
10-9 10-11 10-13
soluzione acida soluzione basica
soluzione
neutra
[H3O+]
[H3O+] > 10-7
[OH-] < 10-7
pH < 7
[H3O+] < 10-7
[OH-] > 10-7
pH > 7
[H3O+] = [OH-] = 10-7
pH = 7
pH < pOH pH > pOH
]
O
H
[
log
pH 3
10
-
]
OH
[
log
pOH 10
-
-
0 2 4 6
1 3 5 7 8 10 12 14
9 11 13
pH](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-22-2048.jpg)



![Relazione tra Ka e Kb - Forza di acidi e basi
Ka
Kb
Kw
Ka = [A-][H3O+]
[HA]
Kb = [OH-][HA]
[A-]
Ka · Kb = [A-][H3O+]·[OH-][HA]
[HA] [A-]
= Kw](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-26-2048.jpg)
![La relazione tra [H3O+], pH, [OH-] e pOH
Poiché Kw è costante,
[H3O+] e [OH-] sono
interdipendenti e
variano in versi
opposti quando
aumenta l’acidità o la
basicità della
soluzione acquosa.
Il pH e il pOH sono
interdipendenti nello
stesso modo:
Kw=[H3O+][OH-]=10-14
pH + pOH = 14](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-27-2048.jpg)



![Acido debole (Ka < 1) in concentrazione ca
HA(aq) + H2O(l) ⇄ A-(aq) + H3O+(aq)
(ca – x) x x
]
HA
[
]
O
H
[
]
A
[ 3
a
-
K )
x
c
(
x
a
2
a
-
K
Se l’acido è così debole che x << ca, allora:
a
a
3 c
]
[A
]
O
[H K
-
](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-31-2048.jpg)
![Base debole (Kb < 1) in concentrazione cb
B(aq) + H2O(l) ⇄ BH+(aq) + OH-(aq)
(cb – x) x x
]
B
[
]
OH
[
]
BH
[
b
-
K
)
x
c
(
x
b
2
b
-
K
Se la base è così debole che x << cb, allora:
b
bc
]
[BH
]
[OH K
-](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-32-2048.jpg)
![Esercizi:
Calcola il pH di una soluzione di acido acetico CH3COOH 0,01 M (Ka = 1,8·10-5)
a
a
3 c
]
[A
]
O
[H K
-
](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-33-2048.jpg)
![L’ammoniaca è una base debole (Kb = 1,8·10-5). Calcola che conc.
deve avere una soluzione di ammoniaca perché il suo pH sia10,04.
] Kb b
[OH c
-
](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-34-2048.jpg)



![NH4Cl(s) NH4
+(aq) + Cl-(aq)
NH4
+ è l’acido coniugato di NH3, e quest’ultimo è
una base debole quindi…
NH4
+(aq) + H2O(l) ⇄ NH3(aq) + H3O+(aq)
]
NH
[
]
O
H
[
]
NH
[
4
3
3
a
K
IDROLISI ACIDA
(Sali formati da acido forte + base debole)
Reazione di Idrolisi acida:
Kidrolisi = = Kw /Kb](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-38-2048.jpg)
![NaNO2(s) Na+(aq) + NO2
-(aq)
NO2
- è la base coniugata di HNO2, e
quest’ultimo è un acido debole quindi…
NO2
-(aq) + H2O(l) ⇄ HNO2(aq) + OH-(aq)
]
NO
[
]
OH
[
]
HNO
[
2
2
b -
-
K
IDROLISI BASICA
(Sali formati da acido debole + base forte)
Reazione di Idrolisi basica:
Kidrolisi = = Kw /Ka](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-39-2048.jpg)
![Esempio:
Il problema è del tutto analogo al caso di una base debole.
Conoscendo la Ka dell'acido acetico (1.8 x 10-5), si determina la Kb
del sale dalla
Ka Kb = Kw
Ovvero Kb = 10-14 / 1.8 x 10-5 = 5.56 x 10-10.
A questo punto, utilizzando la
si calcola la [OH-] (=7.45 x 10-6), da cui il pOH = 5.13 e il pH = 8.87.
] Kb b
[OH c
-
Calcolare il pH di una soluzione 0.1 M di acetato di sodio.](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-40-2048.jpg)

![)
x
c
(
x
)
x
c
(
]
HClO
[
]
O
H
[
]
ClO
[
a
b
3
a
-
-
K
se x << ca
x << cb
es.
HClO(aq) + H2O(l) ⇄ ClO-(aq) + H3O+(aq)
con
ca ≈ cb, ovvero 0.1 < ca/cb < 10
ca cb
b
a
a
3
c
c
]
O
H
[ K
a
3
b
a ;
c
]
O
H
[
c
K
](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-42-2048.jpg)
![Soluzioni Tampone: aggiunta di ioni H+
( )
-
-
-
x
c
x
c
Log
pK
pH
x
c
x
c
O
H
b
a
a
b
a
a
10
3 K
]
[](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-43-2048.jpg)
![Soluzioni Tampone: aggiunta di ioni OH-
-
-
-
x
c
x
c
Log
pK
pH
x
c
x
c
O
H
b
a
a
b
a
a
10
3 K
]
[
Tampone
Acido acetico/acetato:](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-44-2048.jpg)




![Riepilogo:
Acido debole:
Base debole:
Idrolisi acida:
Idrolisi basica:
a
a
3 c
]
O
[H K
b
bc
]
[OH K
-
s
b
w
3 c
]
O
[H
K
K
s
a
w
c
]
[OH
K
K
-](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-49-2048.jpg)
![Riepilogo:
Tampone formato da
un acido debole e la
sua base coniugata:
Tampone formato da
una base debole e il
suo acido coniugato:
b
a
a
c
c
O
H K
]
[ 3
a
b
b
c
c
]
OH
[ K
-](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-50-2048.jpg)



![Ag2CO3(s) ⇄ 2 Ag+(aq) + CO3
2-(aq)
4
3
12
3 ps
3
2
2
3
2
ps
10
16
,
1
4
10
2
,
6
4
s
s
4
s
)
s
2
(
]
CO
[
]
Ag
[
-
-
-
K
K
Solubilità (s, in mol ℓ-1) in acqua pura, a 25°C :
2s s](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-54-2048.jpg)
![CaCO3(s) ⇄ Ca2+(aq) + CO3
2-(aq)
5
9
ps
2
2
3
2
ps
10
3
,
9
10
7
,
8
s
s
]
CO
[
]
Ca
[
-
-
-
K
K
s s
Solubilità (s, in mol ℓ-1) in acqua pura, a 25°C :](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-55-2048.jpg)
![Fe(OH)3(s) ⇄ Fe3+(aq) + 3 OH-(aq)
10
4
36
4
4
3
10
49
,
4
27
10
1
,
1
27
K
27
)
3
(
K
-
-
ps
ps
s
s
s
s
Solubilità a 25°C
in acqua pura:
s 3 s
6
30
36
30
ps
30
3
10
ps
10
1
,
1
10
10
1
,
1
10
s
10
s
)
10
(
s
-
-
-
-
-
-
K
K
Solubilità a 25°C
in [OH-]=10-10:
(ovvero pH = 4)
Solubilità di un sale in presenza di uno ione in comune:](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-56-2048.jpg)
![esercizio
Ad una soluzione contenente ioni Ca2+ e ioni Mg2+ entrambi in
concentrazione 1,70·10-4 M si aggiunge una soluzione contenente ioni
CO3
2- in concentrazione 1,00·10-3 M.
Dire se precipita CaCO3, MgCO3 o entrambi.
Kps (CaCO3) = 1,7·10-8 Kps (MgCO3) = 2,6·10-5
Perché si abbia precipitazione, il prodotto delle concentrazioni dei due
ioni che danno il sale deve essere maggiore del prodotto di solubilità.
[Ca2+] [CO3
2-] = 1,70·10-4 x 1,00·10-3 = 1,70·10-7
1,70·10-7 > Ks → precipita CaCO3
[Mg2+] [CO3
2-] = 1,70·10-4 x 1,00·10-3 =1,70·10-7
1,70·10-7 < Ks → non precipita MgCO3](https://image.slidesharecdn.com/lezione3b2013-130519163239-phpapp01/75/Lezione-3b-2013-57-2048.jpg)