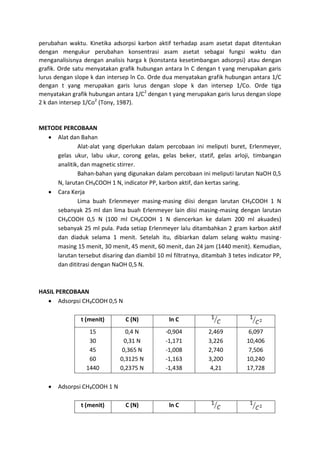
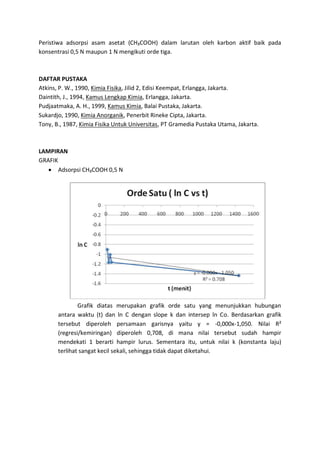
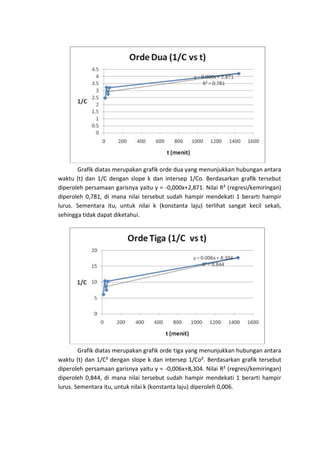
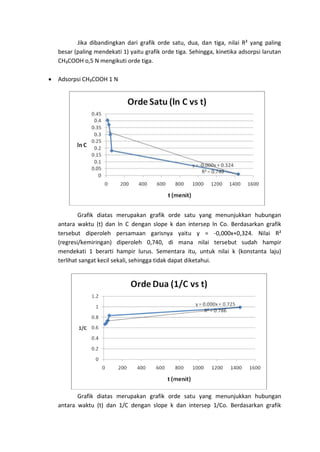
Percobaan ini mengkaji kinetika adsorpsi karbon aktif terhadap asam asetat (CH3COOH) dengan dua konsentrasi yang berbeda. Hasil eksperimen menunjukkan bahwa semakin lama waktu pendiaman, konsentrasi CH3COOH semakin rendah, namun terdapat kejanggalan dimana konsentrasi CH3COOH 1 N meningkat setelah proses adsorpsi. Grafik analisis menunjukkan bahwa adsorpsi memenuhi orde tiga pada kedua konsentrasi CH3COOH.