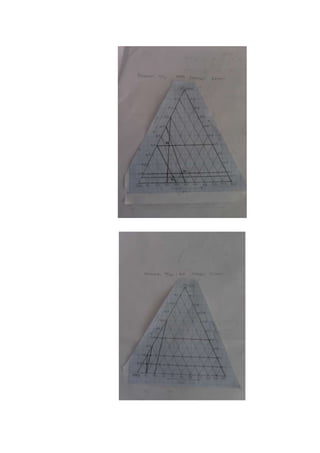
Dokumen tersebut membahas sistem tiga komponen air, kloroform, dan asam asetat. Bertujuan untuk memberikan data kelarutan ketiga komponen dan mengetahui derajat kebebasan sistemnya. Data kelarutan diperoleh dengan menitrasi campuran air dan asam asetat dengan kloroform atau air. Hasilnya digambarkan dalam diagram segitiga untuk mengetahui variasi komposisi ketiga komponen.