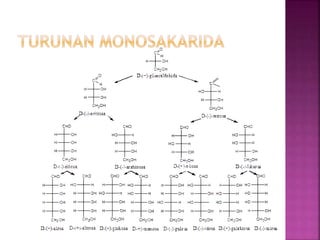
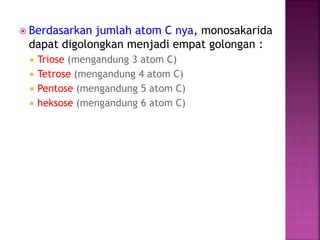
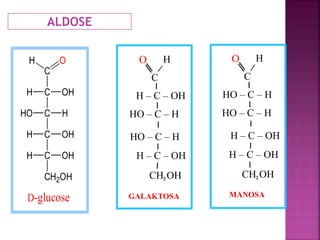
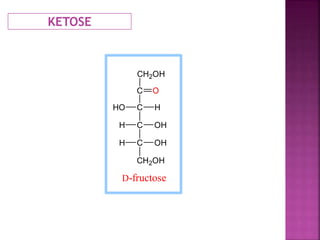
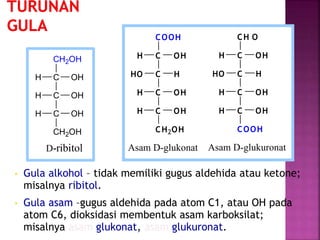
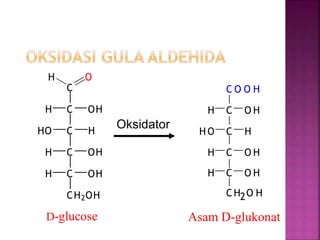
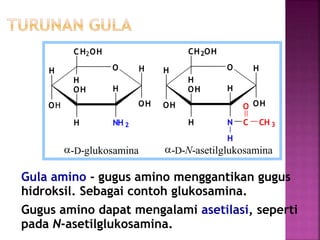
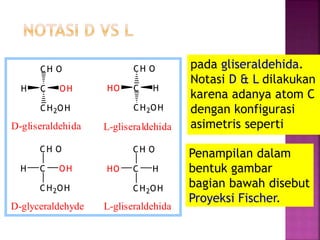
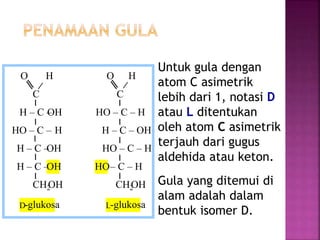
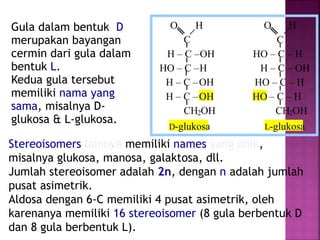
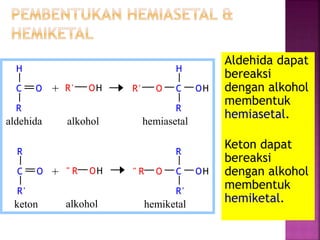
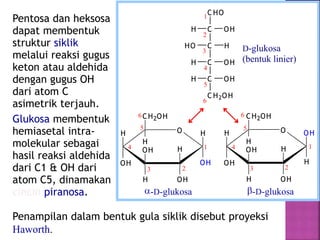
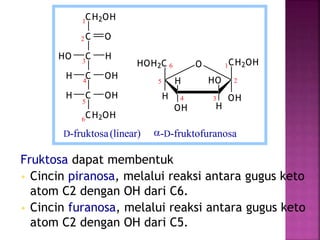
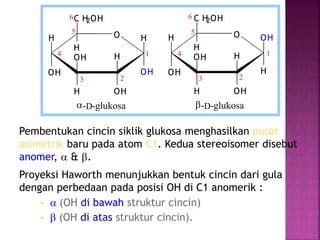
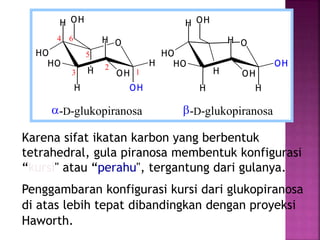
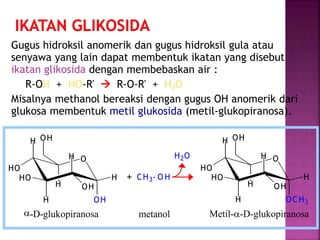
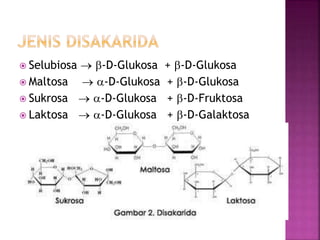
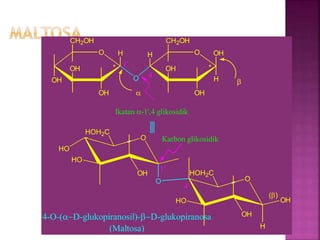
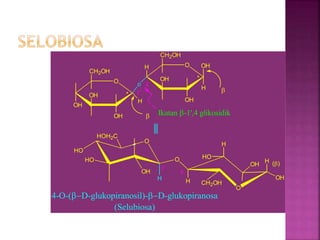
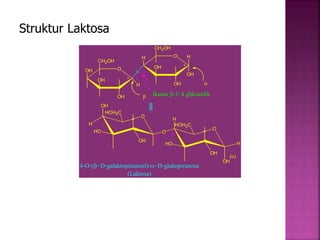
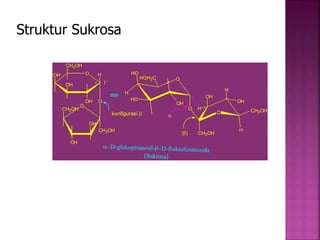
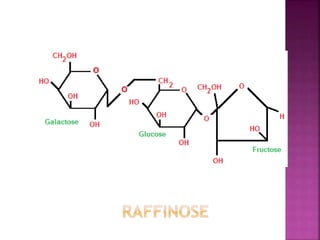
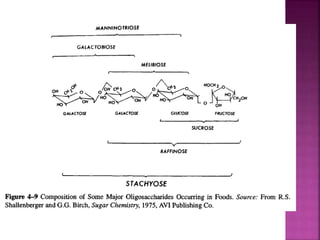
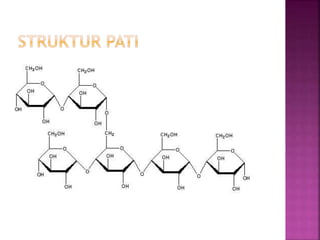
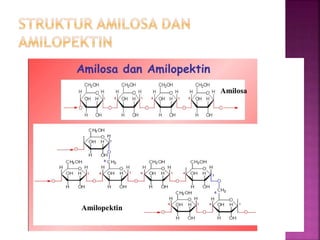
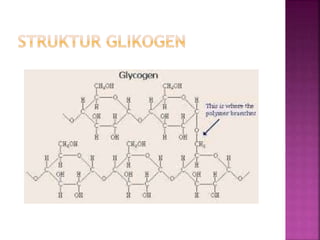
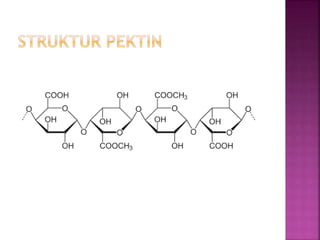
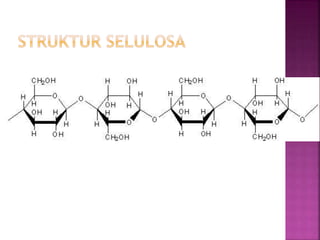
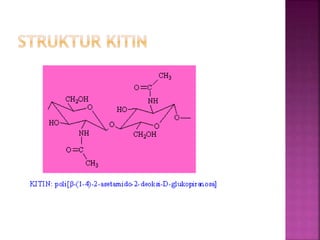
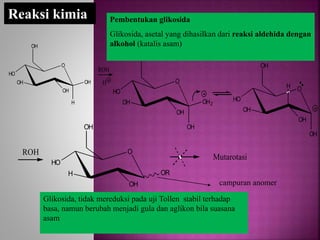
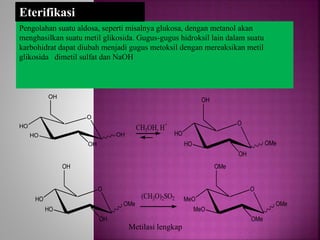
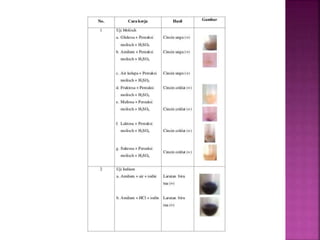
Karbohidrat terdiri dari senyawa organik yang dikelompokkan menjadi monosakarida, disakarida, oligosakarida, dan polisakarida. Struktur dan pengelompokan karbohidrat berdasarkan jumlah atom karbon serta reaksi kimia yang melibatkan ikatan glikosidik dan transformasi struktur, termasuk pembentukan hemiasetal dan hemiketal. Karbohidrat memiliki peran penting dalam biologi, termasuk metabolisme dan penyimpanan energi, serta dapat diidentifikasi melalui reaksinya dengan agen pengoksidasi.